Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 8400-9:2011 về bệnh động vật - quy trình chẩn đoán – phần 9: bệnh viêm gan vịt typ I
TIÊU CHUẨN VIỆT NAM
TCVN 8400-9:2011
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN – PHẦN 9: BỆNH VIÊM GAN VỊT TYP I
Animal disease - Diagnostic procedure - Part 9: Duck virus hepatitis type I disease
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Các phòng thí nghiệm sử dụng tiêu chuẩn này phải tự thiết lập các nguyên tắc bảo đảm an toàn sinh học để không phải bị nhiễm bệnh nghề nghiệp hoặc thất thoát các mầm bệnh từ phòng thí nghiệm ra môi trường.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh viêm gan vịt typ I gây ra cho vịt dưới 6 tuần tuổi.
2. Thuật ngữ, định nghĩa và chữ viết tắt
Trong tiêu chuẩn này sử dụng thuật ngữ, định nghĩa và chữ viết tắt sau:
2.1 Thuật ngữ và định nghĩa
Bệnh viêm gan vịt typ I (Duck virus hepatitis type I disease)
Bệnh truyền nhiễm cấp tính nguy hiểm xảy ra ở vịt, do Avihepatovirus thuộc họ Picornaviridae gây nên.
CHÚ THÍCH: Có 3 typ vi rút khác nhau là: typ I, typ II và typ III. Ở Việt Nam, bệnh viêm gan vịt thường do vi rút typ I gây ra. Bệnh xảy ra chủ yếu ở vịt con từ 1 tuần tuổi đến 6 tuần tuổi, vịt 3 tuần tuổi mẫn cảm nhất.
2.2 Chữ viết tắt
- VN: Virus neutralization (Phản ứng trung hòa vi rút)
– SN: Serum neutralizatuion (Phản ứng trung hòa huyết thanh)
- CPE: Cytopathic pathogene effect (Bệnh tích tế bào)
– FCS: Fetal calf serum (Huyết thanh thai bê)
- DEL: Duck embryo liver (Tế bào gan phôi vịt)
- NI: Neutralization index (Chỉ số trung hòa)
- BSC II: Bio-safety cabinet (Buồng cấy an toàn sinh học cấp II)
- MEM: Modified eagles medium (Môi trường nuôi cấy tế bào)
– CAM: Chorioallantoic membrance (Màng nhung niệu)
- LD50: 50 % Lethal dose (Liều gây chết 50 % động vật thí nghiệm)
– EID50: 50 % Egg infective dose (Liều gây chết 50 % phôi trứng)
- TCID50: 50 % tissue culture infective dose (Liều gây nhiễm 50 % tế bào)
– BHI: Brain heart infusion (Canh thang nước thịt tim não)
3. Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và sử dụng nước cất hai lần (pH 7) hoặc nước đã khử khoáng hoặc nước có độ tinh khiết tương đương không có enzym phân giải RNA (RNAse), trừ khi có quy định khác.
Xem Phụ lục A về mô tả các dung dịch thuốc thử và môi trường.
- Cloroform.
- Hoá chất tiêu độc: formalin, cloramin.
- Môi trường tế bào MEM.
- Môi trường nước thịt (hoặc BHI).
- Môi trường thạch máu.
- Trứng gà có phôi (9 ngày tuổi đến 11 ngày tuổi) hoặc trứng vịt có phôi (10 ngày tuổi đến 14 ngày tuổi).
- Trứng vịt có phôi (14 ngày tuổi đến 16 ngày tuổi) để làm tế bào gan phôi vịt.
- Giống vi rút viêm gan vịt typ I.
- Kháng huyết thanh Viêm gan vịt typ I.
- Các loại kháng sinh Penicillin, Kanamycin, Streptomycin, Mycostatin.
- Kit chiết tách, ví dụ Rneasy Mini kit của hãng Qiagen.
- Kit nhân gen, ví dụ Maxime RT-PCR PreMix kit của hãng iNtRON Biotechnology.
4. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thí nghiệm thông thường và cụ thể như sau:
- Tủ lạnh thường, tủ lạnh âm sâu
- Tủ ấm CO2
- Máy lắc đĩa (orbital shaker)
– Máy lắc trộn (vortex mixer)
- Máy khuấy từ
- Nồi cách thuỷ
– BSC II
– Máy ly tâm
– Kính hiển vi soi tế bào
- Đèn soi trứng
- Tủ ấp trứng
- Bình nón, dung tích 100 ml, 200 ml, 500 ml và 1000 ml
– Ống đong thuỷ tinh, dung tích 50 ml, 100 ml, 200 ml, 500 ml và 1000 ml -Cốc có mỏ, dung tích 100 ml, 200 ml, 500 ml và 1000 ml
- Ống Falcon, dung tích 50 ml, 15 ml
- Pipet thuỷ tinh, dung tích 1 ml, 5 ml và 10 ml
- Micropipet, dung tích từ 0,5 µl đến 10 µl, từ 5 µl đến 50 µl, từ 50 µl đến 200 µl, từ 100 µl đến 1000 µl
– Micropipet đa kênh, dung tích từ 5 µl đên 50 µl, từ 50 µl đến 200 µl
- Đầu tip phù hợp với micropipet
- Bộ cối chày sứ
- Chai nhựa, đĩa nhựa nuôi tế bào: chai nhựa T25, đĩa nhựa 6 giếng, 24 giếng, 96 giếng - Màng lọc Millipor có kích thước lỗ lọc 0,45 µm
- Đĩa Petri
- Dao, kéo, panh kẹp.
5. Cách tiến hành
5.1 Chẩn đoán lâm sàng
5.1.1 Đặc điểm dịch tễ
- Bệnh viêm gan vịt là bệnh truyền nhiễm cấp tính của loài vịt.
- Bệnh xảy ra ở vịt từ 6 tuần tuổi trở xuống. Vịt trưởng thành và các loài gia cầm khác không mắc bệnh.
- Bệnh lây lan nhanh và trầm trọng trong khoảng 2 ngày đến 3 ngày.
- Vịt con dưới 3 tuần tuổi khi mắc bệnh viêm gan do vi rút có tỷ lệ chết rất cao, từ 50 % đến 95 %. Vịt từ 4 tuần tuổi đến 5 tuần tuổi khi mắc bệnh thì tỷ lệ chết rất thấp hoặc không đáng kể.
5.1.2 Triệu chứng lâm sàng
Vịt khi mắc bệnh viêm gan sốt cao, ăn, uống kém, ủ rũ, ít vận động, chỉ nằm một chỗ. Vịt có triệu chứng về thần kinh, khi vận động thì mất thăng bằng, đi liêu xiêu hoặc bị ngã, khi nằm thì hai chân co giật. Sau 2 ngày đến 3 ngày mắc bệnh thì chết. Vịt chết có tư thế rất đặc trưng: chân vịt duỗi thẳng giống như bơi chèo, đầu ngửa hết về phía sau. Người ta gọi đây là tư thế Opisthotonus.
5.1.3 Giải phẫu bệnh học
Bệnh tích đai thể đặc trưng nhất ở gan, gan sưng, trên bề mặt có các điểm xuất huyết. Xung quanh các điểm xuất huyết còn thấy các đám tụ máu. Một số trường hợp lách lốm đốm xuất huyết và sưng, thận tụ máu và có dịch rỉ viêm.
5.1.4 Lấy mẫu và bảo quản
Lấy vô trùng gan, lách, thận của vịt nghi mắc bệnh. Bệnh phẩm sau khi lấy được bảo quản ở nhiệt độ âm 20 0C. Bệnh phẩm để phát hiện kháng thể là mẫu huyết thanh. Máu được lấy vô trùng, lượng tối thiểu là 3 ml, để đông, chắt lấy huyết thanh. Bảo quản ở nhiệt độ từ 2 0C đến 8 0C. Nên lấy ít nhất là 5 mẫu huyết thanh.
Mẫu sau khi lấy được giữ trong điều kiện lạnh, bao gói cẩn thận để không làm lây lan bệnh rồi chuyển tới phòng xét nghiệm càng sớm càng tốt, không chậm hơn 5 ngày để có kết quả xét nghiệm nhanh chóng và chính xác.
5.2 Chẩn đoán phòng thí nghiệm
5.2.1 Bệnh tích vi thể
Tế bào gan hoại tử, thoái hóa xen lẫn tế bào viêm ở các mức độ khác nhau. Tế bào ống mật tăng sinh. Hiện tượng xuất huyết tràn lan trong nhu mô gan.
5.2.2 Phát hiện và giám định vi rút
5.2.2.1 Xử lý bệnh phẩm
Bệnh phẩm gan, lách nghiền trong cối chày sứ với dung dịch PBS (A.2) thành huyễn dịch 10 % sau đó xử lý với kháng sinh penicillin (200 UI/ml) và streptomycin (200 µg/ml), hoặc có thể lọc vô trùng qua màng lọc cỡ lỗ 0,45 µm. Ly tâm huyễn dịch bệnh phẩm 2000 r/min trong 15 min. Hút lấy dịch nước trong ở phía trên khoảng 3 ml đến 4 ml. Xử lý dịch thu được bằng cloroform 5 % trong 15 min ở nhiệt độ phòng. Kiểm tra vô trùng của mẫu trên môi trường BHI hoặc môi trường thạch máu.
5.2.2.2 Phương pháp phân lập vi rút
5.2.2.2.1 Tiêm truyền trên phôi gà hoặc phôi vịt
Dùng phôi gà từ 9 ngày tuổi đến 11 ngày tuổi hoặc phôi vịt từ 10 ngày tuổi đến 14 ngày tuổi.
Tiêm 0,2 ml huyễn dịch bệnh phẩm vào xoang niệu mô hoặc màng CAM của phôi gà hoặc phôi vịt: mỗi mẫu bệnh phẩm tiêm 3 phôi.
Trứng được ấp tiếp ở tủ ấm 37 0C.
Soi trứng hàng ngày, loại bỏ những phôi chết trước 24 h sau khi tiêm.
Vi rút viêm gan vịt thường gây chết phôi gà sau 5 ngày đến 8 ngày tiêm (gây chết phôi vịt từ 1 ngày đến 3 ngày sau khi tiêm).
Mổ phôi thấy hiện tượng: phôi còi cọc, xuất huyết toàn thân, phù nề ở bụng. Gan của phôi có màu đỏ hoặc vàng, xuất huyết và hoại tử rất rõ. Đối với phôi chết muộn hơn, dịch niệu có màu xanh lục.
Thu hoạch gan phôi và dịch niệu để giám định vi rút.
5.2.2.2.2 Tiêm truyền cho vịt con 1 ngày tuổi đến 7 ngày tuổi
Tiêm huyễn dịch bệnh phẩm (5.2.2.1) vào bắp cho vịt con 1 ngày tuổi đến 7 ngày tuổi với liều lượng: 0,5 ml/con. Mỗi mẫu bệnh phẩm tiêm 3 vịt con.
Vi rút viêm gan vịt gây chết vịt trong khoảng 18 h đến 48 h với các triệu chứng và bệnh tích điển hình của bệnh như đã mô tả ở 5.1.2 và 5.1.3.
Mổ khám và thu hoạch gan vịt chết có bệnh tích điển hình. Xử lý gan vịt thu được theo 5.2.2.1 để giám định vi rút.
5.2.2.2.3 Tiêm truyền trên tế bào gan phôi vịt (DEL)
Chuẩn bị tế bào DEL nuôi cấy lên các chai nuôi tế bào T25 hoặc đĩa nuôi cấy 6 giếng hay 24 giếng (xem Phụ lục B). Sau từ 2 ngày đến 3 ngày, tế bào mọc thành thảm (khoảng 80 %) thì gây nhiễm huyễn dịch bệnh phẩm (5.2.2.1) với liều 50 µl/giếng đến 100 µl/giếng hoặc 500 µl/chai.
Kiểm tra tế bào hàng ngày bằng kính hiển vi. Quan sát CPE với đặc điểm thảm tế bào bong tróc, các tế bào co tròn và tụ lại từng đám. CPE thường xuất hiện sau 4 ngày đến 7 ngày gây nhiễm.
Sau 7 ngày thu huyễn dịch tế bào, đông tan, ly tâm và thu dịch nước trong cho giám định vi rút hoặc cấy chuyển lần 2.
5.2.2.3 Phương pháp giám định vi rút
5.2.2.3.1 Phương pháp bảo hộ thụ động cho vịt con
5.2.2.3.1.1 Chuẩn bị
Dùng vịt con từ 1 ngày tuổi đến 7 ngày tuổi khỏe mạnh không có kháng thể viêm gan vịt typ I. Chia làm 2 lô, mỗi lô 3 con.
5.2.2.3.1.2 Cách tiến hành
Lô thí nghiệm: tiêm dưới da mỗi con vịt 1 ml đến 2 ml kháng huyết thanh hoặc kháng thể lòng đỏ viêm gan vịt typ I đặc hiệu.
Lô đối chứng: không tiêm kháng thể.
Sau 24 h, cả 2 lô được công cường độc với liều 1000 LD50 (xem Phụ lục C) vi rút đã phân lập bằng cách tiêm bắp hoặc dưới da.
5.2.2.3.1.3 Đánh giá kết quả
Lô đối chứng (không được tiêm kháng thể viêm gan vịt): vịt chết từ 2 con đến 3 con trong khoảng thời gian từ 18 h đến 48 h, thường từ 18 h đến 24 h.
Lô thí nghiệm (được tiêm kháng thể viêm gan vịt): tỷ lệ bảo hộ đạt 100 %. Kết luận: vi rút phân lập được là vi rút viêm gan vịt typ I.
5.2.2.3.2 Phương pháp trung hòa
5.2.2.3.2.1 Phương pháp trung hòa trên phôi gà hoặc phôi vịt
a) Chuẩn bị
Dùng phôi gà từ 9 ngày tuổi đến 11 ngày tuổi hoặc phôi vịt từ 10 ngày tuổi đến 14 ngày tuổi. Vi rút phân lập được pha loãng với dung dịch PBS (A.2) nồng độ từ 10-1 đến 10-9.
Lô đối chứng dương tính: Trộn kháng huyết thanh dương tính viêm gan vịt typ I với các nồng độ vi rút đã pha loãng theo tỷ lệ 1:1.
Lô đối chứng âm tính: Trộn huyết thanh âm tính với các nồng độ vi rút đã pha loãng theo tỷ lệ 1:1. Ủ hỗn hợp trên ở nhiệt độ 37 0C trong 1 h.
b) Tiến hành
Tiêm hỗn hợp vi rút và huyết thanh trên vào xoang niệu mô với liều 0,2 ml/phôi, mỗi nồng độ tiêm 3 phôi. Sau đó các trứng này lại được ấp tiếp ở tủ ấm 37 0C trong 7 ngày. Soi trứng hàng ngày và loại bỏ những phôi chết trước 24 h.
Phôi gà thường chết sau từ 5 ngày đến 7 ngày còn phôi vịt sau 2 ngày đến 3 ngày. Phôi chết có bệnh tích còi cọc, xuất huyết và phù nề.
c) Đánh giá kết quả
Nếu có vi rút viêm gan vịt typ I, lô đối chứng dương phôi sẽ sống khỏe còn lô đối chứng âm phôi sẽ chết với các triệu chứng và bệnh tích điển hình của bệnh như đã mô tả ở trên.
Tính toán chỉ số trung hòa NI (xem Phụ lục D). Chỉ số trung hòa (NI) là sự chênh lệch giữa EID50 của lô đối chứng dương tính và âm tính. Chỉ số NI lớn hơn hoặc bằng 2 được coi là dương tính.
5.2.2.3.2.2 Phương pháp trung hòa trên vịt con
a) Chuẩn bị
Vịt con từ 1 ngày tuổi đến 7 ngày tuổi khỏe mạnh, không có kháng thể viêm gan vịt.
Vi rút phân lập được pha loãng với dung dịch PBS (A.2) từ nồng độ 10-1 đến 10-9.
Lô đối chứng dương tính: Trộn kháng huyết thanh dương tính viêm gan vịt typ I với các nồng độ vi rút đã pha loãng theo tỷ lệ 1:1.
Lô đối chứng âm tính: Trộn huyết thanh âm tính với các nồng độ vi rút đã pha loãng theo tỷ lệ 1:1. Ủ hỗn hợp trên ở nhiệt độ 37 0C trong 1 h.
b) Tiến hành
Tiêm hỗn hợp vi rút và huyết thanh trên vào bắp cho vịt với lượng 0,5 ml/con, mỗi nồng độ tiêm 3 con. Tiếp tục nuôi vịt bình thường và quan sát theo dõi vịt hàng ngày.
c) Đánh giá kết quả
Nếu có vi rút viêm gan vịt typ I, lô đối chứng dương vịt sẽ sống khỏe, còn lô đối chứng âm vịt sẽ chết trong khoảng từ 18 h đến 48 h với các triệu chứng và bệnh tích điển hình của bệnh như đã mô tả tại
5.1.2 và 5.1.3.
Tính toán chỉ số trung hòa NI (xem Phụ lục D). Chỉ số NI lớn hơn hoặc bằng 2 được coi là dương tính.
5.2.2.3.2.3. Phương pháp trung hòa trên tế bào gan phôi vịt (DEL)
a) Chuẩn bị
Tế bào gan phôi vịt được nuôi cấy trên đĩa tế bào 96 giếng, sau 2 ngày đến 3 ngày đã mọc thành thảm đạt khoảng 80 % đến 90 %.
Vi rút phân lập được pha loãng với môi trường nuôi cấy tế bào (MEM) từ nồng độ 10-1 đến 10-9.
Lô đối chứng dương tính: Trộn kháng huyết thanh dương tính viêm gan vịt typ I với các nồng độ vi rút đã pha loãng theo tỷ lệ 1:1.
Lô đối chứng âm tính: Trộn huyết thanh âm tính với các nồng độ vi rút đã pha loãng theo tỷ lệ 1:1. Ủ hỗn hợp trên ở nhiệt độ 37 0C trong 1 h.
b) Tiến hành
Gây nhiễm hỗn hợp vi rút và huyết thanh trên lên đĩa 96 giếng đã nuôi cấy tế bào DEL: 100 µl/giếng, nhiễm 8 giếng/nồng độ.
Ủ đĩa nuôi cấy ở tủ ấm CO2 ở nhiệt độ 37 0C trong 1 h.
Đổ bỏ hỗn hợp trên, cho môi trường nuôi cấy tế bào MEM (không có FCS): 100 µl/giếng.
Tiếp tục ủ đĩa nuôi cấy ở tủ ấm CO2 ở nhiệt độ 37 0C. Quan sát đĩa hàng ngày dưới kính hiển vi để kiểm tra phát hiện CPE.
c) Đánh giá kết quả
Nếu có vi rút viêm gan vịt typ I, lô đối chứng dương tế bào phát triển bình thường, còn lô đối chứng âm CPE xuất hiện từ 3 ngày đến 7 ngày sau khi nhiễm
Tính toán chỉ số trung hòa NI (xem Phụ lục D). Chỉ số NI lớn hơn hoặc bằng 2 được coi là dương tính.
5.2.2.4. Phương pháp RT- PCR
5.2.2.4.1. Nguyên tắc
Phản ứng chuỗi polyme phiên mã ngược dùng để phát hiện ARN của vi rút viêm gan vịt.
5.2.2.4.2. Các bước tiến hành (xem Phụ lục E)
Chiết tách ARN bằng kit theo hướng dẫn của nhà sản xuất, sau đó chạy RT-PCR.
5.2.3. Phát hiện kháng thể
Mẫu bệnh phẩm để tiến hành phản ứng là huyết thanh lấy vào thời gian sau 10 ngày từ khi dịch xảy ra đối với vịt chưa được tiêm phòng vacxin Viêm gan vịt typ I, hoặc sau 3 tuần đến 4 tuần đối với vịt đã tiêm phòng.
Xử lý mẫu huyết thanh ở 56 0C trong 30 min để diệt bổ thể trước khi xét nghiệm.
Sử dụng một trong ba phương pháp trung hòa (SN) sau để phát hiện kháng thể
5.2.3.1. Phương pháp trung hòa trên phôi gà hoặc phôi vịt
5.2.3.1.1. Chuẩn bị
Dùng phôi gà từ 9 ngày tuổi đến 11 ngày tuổi hoặc phôi vịt từ 10 ngày tuổi đến 14 ngày tuổi.
Pha loãng mẫu huyết thanh với dung dịch PBS (A.2) theo cơ số 2 ở 10 nồng độ (1/5, 1/10,...1/2560).
Pha vi rút viêm gan vịt typ I với dung dịch PBS pH 7,2 (A.2) với liều 100 EID50.
5.2.3.1.2. Tiến hành
Trộn vi rút viêm gan vịt và huyết thanh kiểm tra đã chuẩn bị ở trên theo tỷ lệ 1:1. Ủ hỗn hợp vi rút và huyết thanh này ở tủ ấm 37 0C trong 1 h.
Tiêm hỗn hợp vi rút và huyết thanh trên vào xoang niệu mô phôi trứng: 0,2 ml/phôi, mỗi một nồng độ tiêm 3 phôi.
Sau đó các trứng này lại được ấp tiếp ở tủ ấm 37 0C trong 9 ngày với phôi gà và 12 ngày với phôi vịt. Soi trứng hàng ngày và loại bỏ những phôi chết trước 24 h.
5.2.3.1.3. Đánh giá kết quả
Nếu huyết thanh có kháng thể viêm gan vịt typ I, phôi sẽ sống còn nếu huyết thanh không có kháng thể phôi sẽ chết (sau 5 ngày đến 7 ngày đối với phôi gà và 2 ngày đến 3 ngày với phôi vịt). Phôi chết có bệnh tích còi cọc, xuất huyết và phù nề.
Tính toán 50 % điểm kết thúc trung hòa (SN50) và hiệu giá trung hòa theo công thức của Reed Muench (xem Phụ lục D).
Điểm kết thúc trung hòa được coi là bảo hộ 50 % động vật thí nghiệm.
5.2.3.2. Phương pháp trung hòa trên vịt con 1 ngày tuổi đến 7 ngày tuổi
5.2.3.2.1. Chuẩn bị
Vịt con khỏe mạnh từ 1 ngày tuổi đến 7 ngày tuổi, không có kháng thể viêm gan vịt.
Pha loãng mẫu huyết thanh với dung dịch PBS (A.2) theo cơ số 2 ở 10 nồng độ (1/5, 1/10,... 1/2560). Pha vi rút viêm gan vịt typ I với dung dịch PBS (A.2) liều 1000 LD50.
5.2.3.2.2 Tiến hành
Trộn vi rút viêm gan vịt và huyết thanh kiểm tra đã chuẩn bị ở trên theo tỷ lệ 1:1. Ủ hỗn hợp vi rút/huyết thanh này ở tủ ấm 37 0C trong 1 h
Tiêm hỗn hợp vi rút/huyết thanh trên vào bắp cho vịt với lượng 0,5 ml/con, mỗi một nồng độ tiêm 3 con. Tiếp tục nuôi vịt bình thường và quan sát theo dõi vịt hàng ngày.
Nếu huyết thanh có kháng thể viêm gan vịt typ I, vịt sẽ sống còn nếu huyết thanh không có kháng thể vịt sẽ chết trong khoảng 18 h đến 72 h, với các triệu chứng, bệnh tích điển hình của bệnh viêm gan vịt.
Tính toán 50 % điểm kết thúc trung hòa (SN50) và hiệu giá trung hòa theo công thức của Reed Muench (xem Phụ lục D).
Điểm kết thúc trung hòa được coi là bảo hộ 50 % động vật thí nghiệm.
5.2.3.3 Phương pháp trung hòa trên tế bào gan phôi vịt DEL
5.2.3.3.1 Chuẩn bị
Tiến hành pha loãng tế bào DEL với môi trường nuôi cấy MEM với số lượng cần thiết (5x104 tế bào/ml). Pha vi rút viêm gan vịt typ I chuẩn với môi trường MEM liều 100 TCID50
5.2.3.3.2 Tiến hành trên đĩa nuôi cấy tế bào 96 giếng
Cho môi trường nuôi cấy MEM (không có FCS) vào tất cả các giếng của đĩa: 50 µl/giếng. Cho mẫu huyết thanh kiểm tra : 50 µl vào giếng đầu tiên của cột 1.
Pha loãng mẫu huyết thanh theo cơ số 2 (1/2, 1/4,...) từ cột 1 đến cột 12. Cho vi rút viêm gan vịt typ I vào các giếng: 50 µl/giếng.
Ủ đĩa nuôi cấy ở tủ ấm CO2 ở nhiệt độ 37 0C trong 1 h.
Cho tiếp vào các giếng dung dịch môi trường có tế bào DEL đã pha ở trên: 100 µl/giếng.
Tiếp tục ủ đĩa nuôi cấy ở tủ ấm CO2 ở nhiệt độ 37 0C trong 5 ngày đến 7 ngày. Soi đĩa hàng ngày dưới kính hiển vi để kiểm tra bệnh tích tế bào.
5.2.3.3.3 Đánh giá kết quả
Nếu huyết thanh có kháng thể viêm gan vịt typ I sẽ không xuất hiện CPE, ngược lại huyết thanh không có kháng thể thì sau 3 ngày đến 7 ngày sẽ có CPE.
Tính toán 50 % điểm kết thúc trung hòa (SN50) và hiệu giá trung hòa theo công thức của Reed Muench (xem Phụ lục D).
Điểm kết thúc trung hòa có hiệu giá huyết thanh pha loãng tại đó bảo hộ 50 % động vật thí nghiệm.
6. Kết luận
Vịt được xác định mắc bệnh viêm gan vịt typ I khi có các đặc điểm dịch tễ học, triệu chứng lâm sàng của bệnh viêm gan vịt và kết quả dương tính với một trong hai phương pháp xét nghiệm sau:
- Phân lập và giám định được vi rút viêm gan vịt typ I trong mẫu bệnh phẩm.
- Phát hiện được kháng thể viêm gan vịt typ I trên đàn vịt chưa được tiêm phòng.
PHỤ LỤC A
(Quy định)
THÀNH PHẦN VÀ CHUẨN BỊ DUNG DỊCH THUỐC THỬ
A.1. Dung dịch kháng khuẩn
Penicillin 1.000.000 UI
Mycostatin 250.000 UI
Streptomycin 200 mg
Kanamycin 1.000.000 UI
Nước 10 ml
Hòa tan các kháng sinh bằng nước rồi lọc bằng màng lọc cỡ 0,45 µm. Bảo quản ở ngăn đá tủ lạnh.
A.2. Dung dịch PBS pH 7,2
NaCl 8 g
KCl 2 g
Na2HPO4 1,15 g
KH2PO4 0,2 g
Nước 1000 ml
Chỉnh pH đến 7,2 bằng dung dịch NaOH 1 N hoặc dung dịch HCl 1 N. Hấp tiệt trùng. Bảo quản ở 4 0C.
A.3. Dung dịch NaHCO3 7 %
NaHCO3 7 g
Nước 100 ml
Hấp tiệt trùng và bảo quản ở 4 0C.
A.4. Dung dịch L-glutamin 3 %
L-glutamin 3 g
Nước 100 ml
Lọc vô trùng bằng lọc Millipor 0,45 µm, bảo quản ở - 20 0C.
A.5. Canh thang Tryptose Phosphat (TPB)
Tryptose phosphat 29,5 g
Nước 1000 ml
Hấp tiệt trùng, bảo quản ở 4 0C.
A.6. Dung dịch trysin 2,5% (10X)
Trypsin 2,5 g
Nước 100 ml
Khuấy bằng que khuấy từ qua đêm ở 4 0C, lọc vô trùng bằng lọc Millipor 0,45 µm. Bảo quản ở - 200C
A.7. Môi trường nuôi cấy tế bào (MEM)
MEM 430 ml
Canh thang Tryptose phosphat (TPB) 50 ml
L-glutamin 3 % 5 ml
NaHCO3 7 % 5 ml
Kháng sinh (streptomycin và penicilin) 5 ml
FCS 5 ml
A.8. Chuẩn bị đoạn gen mồi cho quá trình nhân gen
Mồi đông khô phải được ly tâm ngắn để chắc chắn rằng mồi được lắng xuống đáy ống trước khi mở và hoàn nguyên. Trước tiên nên dùng dung dịch đệm TE để hoàn nguyên mồi ở nồng độ 200 pmol/µl làm mồi gốc.
Mồi sử dụng ở nồng độ 10 pmol/µl: pha loãng mồi gốc bằng nước không có nuclease.
Mồi gốc 10 µl
Nước không chứa RNAse 90 µl
Tổng lượng 100 µl
PHỤ LỤC B
(Quy định)
PHƯƠNG PHÁP TẠO VÀ NUÔI CẤY TẾ BÀO GAN PHÔI VỊT
B.1. Chuẩn bị
Phôi trứng vịt khỏe mạnh từ 14 ngày tuổi đến 16 ngày tuổi.
Dung dịch PBS pH 7,2 (A.2) chứa 1 % dung dịch kháng khuẩn (A.1).
Dung dịch trypsin 0,25 % [pha loãng 10 lần trypsin 2,5 % với PBS pH 7,2 (A.2)]. Môi trường MEM và huyết thanh thai bê FCS.
Đĩa petri, panh, kéo, cốc đong thủy tinh, chai tam giác vô trùng.
B.2. Tiến hành
Sát trùng trứng bằng cồn 70 %, mổ trứng lấy phôi vịt.
Rửa phôi 3 lần bằng dung dịch PBS pH 7,2 (A.2) có chứa 1 % kháng sinh trong đĩa petri. Bộc lộ gan phôi, thu hoạch lấy gan phôi sang một đĩa petri khác.
Rửa gan phôi 1 lần đến 2 lần trong dung dịch PBS pH 7,2 (A.2) có chứa 1 % kháng sinh. Cắt nhỏ gan phôi, đổ vào chai tam giác.
Cho dung dịch trypsin ấm 0,25 % vào để tách gan phôi và lắc nhẹ 250 r/min trong 15 min.
Thu hoạch tế bào đã tách trong phần nước trong ở trên cho vào môi trường MEM có 10 % FCS.
Tiếp tục cho dung dịch trypsin 0,25 % vào phần tổ chức còn lại để tách tiếp tế bào. Thực hiện như vậy 2 lần đến 3 lần.
Chuyển toàn bộ phần huyễn dịch tế bào thu được sang ống Falcon 50 ml vô trùng, ly tâm 1500 r/min trong 5 min.
Đổ bỏ phần nước trên, giữ lại phần tế bào gan phôi lắng ở đáy ống Falcon, rửa bằng môi trường MEM.
Đếm và pha loãng tế bào với môi trường phát triển MEM có 10% FCS, lượng tế bào cần thiết tối thiểu là 4 x 105 tế bào/ml.
Chuẩn bị môi trường phát triển MEM có 10 % FCS, chia vào các chai nuôi cấy với lượng cần thiết (25 ml cho chai T75, 10 ml cho chai T25). Sau đó dùng pipet chuyển dung dịch môi trường có chứa tế bào ở trên vào các chai với lượng 5ml cho chai T75, 3 ml cho chai T25.
Đối với đĩa để nuôi cấy (đĩa 6 giếng, hoặc 24 giếng hoặc 96 giếng) thì tế bào được pha loãng luôn với môi trường phát triển MEM có 10 % FCS, rồi chia vào các giếng với tỷ lệ theo quy định để đảm bảo tối thiểu có 5 x 104 tế bào/ml (với đĩa 6 giếng là 3 ml/giếng, với đĩa 24 giếng là 1 ml/ giếng, với đĩa 96 giếng là 100 µl/giếng).
Sau đó nuôi ở tủ ấm 37 0C có 5 % CO2. Sau 1 ngày đến 2 ngày đổ bỏ môi trường cũ, rửa sạch thảm tế bào bằng dung dịch PBS (A.2), cho tiếp môi trường phát triển MEM mới vào nuôi tiếp. Khi tế bào mọc đạt 80 % đến 90 % thì có thể sử dụng.
PHỤ LỤC C
(Quy định)
CÔNG THỨC TÍNH LIỀU GÂY CHẾT 50% ĐỘNG VẬT THÍ NGHIỆM (LD50) CỦA REED MUENCH

PHỤ LỤC D
(Quy định)
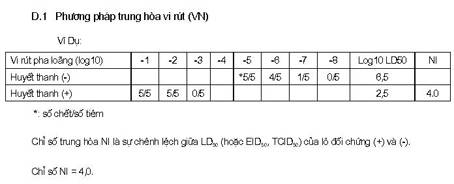
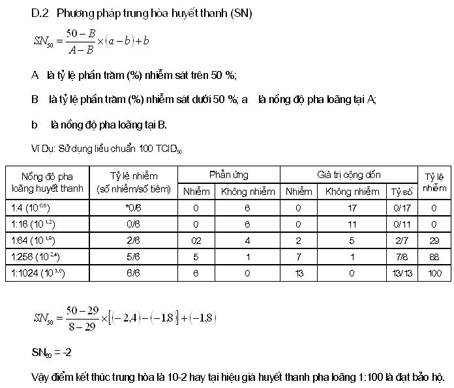
CÔNG THỨC TÍNH CHỈ SỐ TRUNG HÒA NI CỦA REED MUENCH
PHỤ LỤC E
(Quy định)
QUY TRÌNH RT-PCR PHÁT HIỆN ARN VI RÚT VIÊM GAN VỊT
E.1. Chiết tách ARN
Theo hướng dẫn của nhà sản xuất.
E.2. Tiến hành phản ứng RT-PCR
Áp dụng cho bộ Maxime RT-PCR PreMix kit (iNtRON Biotechnology) (nếu dùng bộ kit khác có thể thay đổi công thức pha chế)
Nguyên liệu | Thể tích, µl |
H2O | 9 |
Dung dịch đệm RT- PCR (Tris/HCl và KCl) | 1 |
OptiScript reverse transcriptase | 2 |
dNTP | 1 |
i-StarTaq DN A polymerase | 1 |
Mồi xuôi | 1 |
Mồi ngược | 1 |
Mẫu ARN | 4 |
Tổng cộng | 20 |
Mồi | Chiều | Chuỗi (5‘ - 3‘) | Kích thước, bp |
DHV-1 Com F | Xuôi | AAG-AAG-GAG-AAA-ATY-[C hoặc T]-AAG-GAA-GG | 467 |
DHV-1 Com R | Ngược | TTG-ATG-TCA-TAG-CCC-AAS- [C hoặc G]-ACA-GC |
E.3. Chu trình nhân gen
Bước | Chu kỳ | Thời gian | Nhiệt độ, 0C |
Bước 1 | 1 chu kỳ | 30 min | 45 |
Bước 2 | 1 chu kỳ | 5 min | 94 |
| 1 chu kỳ | 20 s | 94 |
Bước 3 |
| 30 s | 52 |
| 40 chu kỳ | 30 s | 72 |
|
| 20 s | 94 |
Bước 4 | 1 chu kỳ | 5 min | 72 |
Bước 5 | 1 chu kỳ | ∞ | 4 |
E.4. Chạy điện di
Chuẩn bị thạch agaroze 2 % pha trong dung dịch TAE 1X hoặc TBE 1X có ethidi bromua (10 µg/µl). Đổ thạch vào khuôn điện di có lược.
Thạch khô, rút lược ra và cho mẫu vào các giếng (8 µl sản phẩm PCR + 2 µl dung dịch tải).Sử dụng thang chuẩn (Marker) 100 bp trở lên.
Chú ý khi chạy PCR phải có mẫu đối chứng dương và mẫu đối chứng âm đi kèm (mẫu đối chứng âm có thể là nước).
E.5. Đọc kết quả
Mẫu dương tính: Xuất hiện vạch và có kích thước bằng kích thước mẫu đối chứng dương.Mẫu âm tính: Không có vạch.
E.6. Đánh giá kết quả
Có vi rút viêm gan vịt typ I trong mẫu bệnh phẩm nếu kết quả RT-PCR dương tính.