Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 8400-13:2011 về bệnh động vật - quy trình chẩn đoán - phần 13: bệnh sảy thai truyền nhiễm do Brucela
TIÊU CHUẨN VIỆT NAM
TCVN 8400-13:2011
BỆNH ĐỘNG VẬT - QUY TRÌNH CHẨN ĐOÁN - PHẦN 13: BỆNH SẢY THAI TRUYỀN NHIỄM DO BRUCELA
Animal disease - Diagnostic procedure - Part 13: Brucellosis
CẢNH BÁO - Việc áp dụng tiêu chuẩn này có thể liên quan đến các vật liệu, thiết bị và các thao tác gây nguy hiểm. Tiêu chuẩn này không thể đưa ra được hết tất cả các vấn đề an toàn liên quan đến việc sử dụng chúng. Các phòng thí nghiệm sử dụng tiêu chuẩn này phải tự thiết lập các nguyên tắc bảo đảm an toàn sinh học để không phải bị nhiễm bệnh nghề nghiệp hoặc thất thoát các mầm bệnh từ phòng thí nghiệm ra môi trường.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định quy trình chẩn đoán bệnh sảy thai truyền nhiễm đối với gia súc.
2. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng thuật ngữ và định nghĩa sau:
Bệnh sảy thai truyền nhiễm do Brucela (Brucellosis)
Bệnh truyền nhiễm chung do vi khuẩn thuộc giống Brucella gây ra trên nhiều loài gia súc và lây sang người, gây sảy thai, chết lưu thai và bất dục.
CHÚ THÍCH: Các vi khuẩn thuộc giống Brucella là cầu trực khuẩn bắt màu Gram âm. Đường truyền lây của bệnh sảy thai truyền nhiễm do brucela chủ yếu qua thức ăn nước uống, qua đường giao phối, qua sữa và các sản phẩm từ thịt, sữa… bị nhiễm mầm bệnh.
3. Thuốc thử và vật liệu thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và sử dụng nước cất hoặc nước đã khử khoáng hoặc nước có độ tinh khiết tương đương không có Rnase, trừ có quy định khác.
- Dung dịch EDTA-PBS pH 7,2
- Dung dịch tím tinh thể
- Dung dịch Gam’s Iodine để nhuộm vi khuẩn
- Metanol
- Bộ kit ELISA
- Thuốc nhuộm
- Thạch TSA (trypticase soy agar hoặc tryptone soy agar) - Thạch máu (oxoid)
- Kháng nguyên Rose Bengal Brucella (được bảo quản ở 2 0C đến 8 0C)
- Huyết thanh đối chứng dương (được bảo quản ở 2 0C đến 8 0C)
- Huyết thanh đối chứng âm (được bảo quản ở 2 0C đến 8 0C)
- Bổ thể
- Dung dịch muối đệm Veronal
- Kháng nguyên chuẩn và kháng nguyên pha loãng để sử dụng.
- Hệ thống dung huyết: trộn một lượng bằng nhau của hồng cầu cừu (SRBC) 3 % và 5MHD dung huyết tố (MHD: liều dung huyết tối thiểu của bổ thể).
- Kháng nguyên Brucella làm phản ứng vòng sữa (được bảo quản ở 2 0C đến 8 0C) - Bộ KIT huyết thanh hoặc sữa.
4. Thiết bị và dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
- Kính hiển vi
- Lam kính
- Ống nghiệm thủy tinh
- Đèn cồn
- Đĩa lồng petri
- Que cấy
- Buồng cấy sinh học
- Pipet đơn kênh, thể tích hút từ 10 l đến 1000 l, từ 1 l đến 10 l, từ 5 l đến 50 l - Pipet đa kênh, thể tích hút từ 25l đến 200 l
- Máy lắc, tủ ấm, tủ lạnh
- Nồi cách thủy
- Đĩa nhựa 96 giếng
- Lam kính, que trộn mẫu, đồng hồ phòng thí nghiệm - Máy đọc ELISA.
5. Cách tiến hành
5.1. Chẩn đoán lâm sàng
5.1.1. Đặc điểm dịch tễ
Bệnh sảy thai truyền nhiễm là bệnh lây sang người, ở nhiều loài động vật khác và động vật hoang dã. Có ba chủng chính gây bệnh là:
- Brucella abortus (biovars 1 - 6) gây bệnh chủ yếu ở gia súc, loài bò, hươu nai. - Brucella suis (biovars 1 - 5) gây bệnh chủ yếu ở lợn.
- Brucella melitensis (biovars 1 - 3) gây bệnh chủ yếu ở dê, cừu.
Tất cả các chủng trên đều không có vật chủ trung gian mà chúng có thể lây bệnh qua các loài động vật khác khi có điều kiện thích hợp như qua tiêu hóa, giao cấu, con bú mẹ...
Bệnh có hầu hết ở các nước trên thế giới trừ những nước đã thanh toán được bệnh này.
5.1.2 Triệu chứng lâm sàng
5.1.2.1 Bệnh sảy thai truyền nhiễm trên trâu bò (do Brucella abortus) Con cái: Sảy thai, đẻ non, sát nhau, bất dục.
Con đực: Viêm tinh hoàn và mào tinh hoàn, bao dịch hoàn sưng to, túi tinh sưng, sưng khớp gối.
5.1.2.2 Bệnh sảy thai truyền nhiễm trên dê (do Brucella melitensis) Con cái: Sảy thai ở giai đoạn cuối, chân đi khập khiễng.
Con đực: Viêm tinh hoàn.
5.1.2.3 Bệnh sảy thai truyền nhiễm trên cừu (do Brucella ovis) Con cái: Sảy thai vào giai đoạn cuối, con sinh ra yếu hoặc chết.
Con đực: Bao dịch hoàn sưng to, gia súc sốt cao, ủ rũ, mào tinh hoàn sưng to và rắn, tinh hoàn teo nhỏ.
5.1.2.4 Bệnh sảy thai truyền nhiễm trên lợn (do Brucella suis) Con cái: Sảy thai, bất dục, tỷ lệ lợn con sinh ra bị chết cao.
Con đực: Viêm sưng hoặc hoại tử tinh hoàn, què hoặc liệt chân sau, viêm tinh hoàn và mào tinh hoàn.
5.1.3 Bệnh tích đại thể
Bệnh tích ở các loài đều gần giống nhau. Bệnh tích trên bào thai của những con thú sảy thai: vỏ bọc thai dày lên có nhiều điểm xuất huyết. Trên núm nhau có nhiều điểm hoại tử. Nhau thai có những điểm hoại tử dạng hạt màu vàng trắng, bờ mặt đục. Núm nhau bị biến màu, sờ vào mềm nhũn có mủ. Cuống rốn có mủ, điểm hoại tử lấm tấm.
Con đực: dịch thượng hoàn sưng to gấp 2 lần đến 3 lần bình thường, lượng tinh giảm, màng ngoài đường sinh dục dày, có khi bị viêm khớp u mềm có mủ.
Cơ quan phủ tạng: gan lách sưng hay hoại tử.
5.2. Lấy mẫu, bảo quản
5.2.1. Lấy mẫu
5.2.1.1. Gia súc mới chết
Bệnh phẩm có thể là nhau thai, thai bị sảy, nước ối, hạch vú, hạch vùng xoang chậu, tuyến sữa, tử cung, dịch tiết âm đạo, tinh hoàn, dịch khớp.
5.2.1.2 Gia súc sống
Máu: Lấy máu tĩnh mạch vào buổi sáng trước khi cho gia súc ăn. Sữa: Lấy khoảng 10 ml sữa vào lọ vô trùng.
Dịch bài xuất, bài tiết từ âm hộ: dùng tăm bông vô trùng để thấm dịch và cho vào lọ vô trùng.
Tinh dịch: lấy khoảng 3 ml cho vào lọ vô trùng.
5.2.2 Bảo quản và vận chuyển
Mẫu bệnh phẩm gửi đi xét nghiệm phải được bảo quản trong thùng lạnh ở nhiệt độ 4 0C và vận chuyển ngay đến phòng thí nghiệm càng nhanh càng tốt. Tốt nhất là vận chuyển ngay trong ngày lấy mẫu.
Gửi kèm theo cả biên bản mổ khám (nếu có).
5.3. Chẩn đoán phòng thí nghiệm
5.3.1. Chẩn đoán huyết thanh học
Là phương pháp phổ biến nhất được áp dụng cho việc đánh giá đàn gia súc được kiểm tra là có hay không bệnh sảy thai truyền nhiễm. Các phản ứng huyết thanh dùng để kiểm tra toàn đàn, kiểm tra định kỳ và kiểm tra mẫu huyết thanh trong trường hợp có hiện tượng gia súc bị sảy thai.
5.3.1.1. Phản ứng ngưng kết hoa hồng (Phản ứng RBT - Rose Bengal Test)
5.3.1.1.1 Nguyên lý phản ứng
Kháng thể có trong huyết thanh kết hợp với kháng nguyên Brucella đã được gắn màu để tạo thành phức hợp kháng nguyên kháng thể mà có thể quan sát thấy (phức hợp này là những hạt chấm màu đỏ trong dung dịch trong suốt).
5.3.1.1.2 Tiến hành phản ứng
- Nguyên liệu phản ứng và mẫu huyết thanh để ở nhiệt độ phòng (22 0C ± 4 0C) khoảng 1 h trước khi làm phản ứng.
- Lắc đều lọ kháng nguyên một cách nhẹ nhàng để kháng nguyên chắc chắn được đồng nhất.
- Nhỏ 30 µl mẫu huyết thanh lên trên phiến kính.
- Nhỏ 30 µl kháng nguyên lên huyết thanh.
- Trộn đều mẫu huyết thanh với kháng nguyên bằng que trộn.
- Lặp lại các bước trên với huyết thanh đối chứng âm, dương.
- Nhẹ nhàng lắc tròn phiến kính trong 2 min (có thể sử dụng máy lắc).
Quan sát sự ngưng kết sau 2 min kể từ lúc bắt đầu lắc là khoảng thời gian tốt nhất để đánh giá kết quả.
5.3.1.1.3 Đánh giá kết quả
Phản ứng âm tính: không có sự ngưng kết.
Phản ứng dương tính (có mặt kháng thể đặc hiệu): có các hạt ngưng kết lấm tấm màu hồng.
5.3.1.2 Phản ứng vòng sữa (Milk Ring Test)
5.3.1.2.1 Nguyên lý phản ứng
Kháng thể có trong sữa kết hợp với kháng nguyên Brucella đã được gắn màu để tạo thành phức hợp kháng nguyên kháng thể. Khi phức hợp này được tạo thành nó kéo theo lớp chất béo có trong sữa nổi lên trên và tạo thành vòng xanh tím.
5.3.1.2.2 Tiến hành phản ứng
Cho 10 ml mẫu sữa vào ống nghiệm.
Thêm 50 µl kháng nguyên Brucella đã gắn màu và trộn đều một cách cẩn thận.
Đặt vào tủ ấm 37 0C trong 1 h hoặc tủ lạnh 4 0C từ 18 h đến 20 h, sau đó đọc kết quả.
5.3.1.2.3 Đánh giá kết quả
- Dương tính: lớp kem phía trên có màu xanh tím bằng hoặc đậm hơn màu của lớp sữa phía dưới.
- Âm tính: lớp kem phía trên có màu xanh tím nhạt hơn màu của lớp sữa phía dưới.
CHÚ Ý: Hai phản ứng trên đây chỉ là phản ứng sàng lọc để phát hiện sự có mặt hay không của kháng thể. Nếu phản ứng cho kết quả dương tính thì phải tiến hành kiểm tra lại bằng các phản ứng huyết thanh học khác.
5.3.1.3 Phản ứng ngưng kết trong ống nghiệm (phản ứng EDTA-TAT - EDTA-Tube agglutination test)
5.3.1.3.1 Nguyên lý phản ứng
Kháng thể có trong huyết thanh kết hợp với kháng nguyên Brucella để tạo thành phức hợp kháng nguyên kháng thể mà có thể quan sát thấy.
5.3.1.3.2 Tiến hành phản ứng
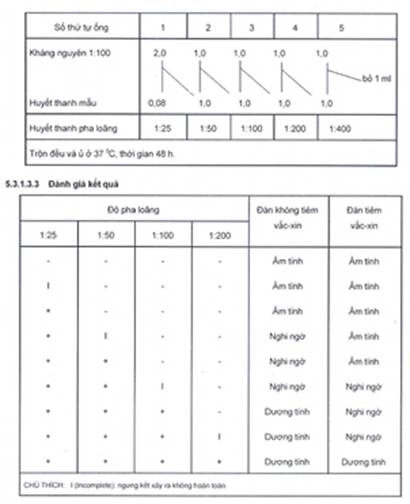
Pha loãng kháng nguyên với tỷ lệ 1:100 bằng EDTA-PBS
Chuẩn bị 5 ống nghiệm thủy tinh vô trùng đánh dấu thứ tự từ 1 đến 5, lấy kháng nguyên đã pha loãng vào các ống theo thứ tự từ 1 đến 5 như sau: 2,0; 1,0; 1,0; 1,0 và 1,0 ml.
Cho 0,08 ml huyết thanh cần kiểm tra vào ống 1.
Trộn đều và pha loãng bằng cách chuyển 1 ml huyễn dịch ống 1 sang ống 2, trộn đều và chuyển 1 ml của ống 2 sang ống 3, tiếp tục đến ống thứ 5 và bỏ 1 ml cuối cùng. Như vậy các ống có độ pha loãng của huyết thanh theo thứ tự là: 1:25, 1:50, 1:100, 1:200, 1:400.
Ủ ở 37 0C, thời gian 48 h.
Các bước tiến hành được tóm tắt ở bảng dưới đây:
5.3.1.4 Kỹ thuật chẩn đoán bằng phương pháp ELISA (phản ứng miễn dịch đánh dấu enzym- Enzyme-Linked Immunosorbent Assays)
5.3.1.4.1 Nguyên lý phản ứng
Dùng kháng thể hoặc kháng kháng thể gắn enzym rồi cho kết hợp trực tiếp hay gián tiếp với kháng nguyên. Sau đó cho cơ chất (chất nền) vào, cơ chất sẽ kết hợp với enzym đã gắn tạo nên màu.
5.3.1.4.2 Tiến hành phản ứng
Theo hướng dẫn của nhà sản xuất KIT.
5.3.1.4.3 Đánh giá kết quả
Theo hướng dẫn của nhà sản xuất KIT.
5.3.1.5 Phản ứng kết hợp bổ thể CFT (Kolmer CFT)
5.3.1.5.1 Nguyên lý phản ứng
Kháng thể trong huyết thanh kết hợp với kháng nguyên và bổ thể sẽ không dung giải tế bào hồng cầu cừu vì vậy hiện tượng dung huyết không xảy. Nếu huyết thanh không có kháng thể, bổ thể sẽ gây dung giải hồng cầu và hiện tượng dung huyết tố sẽ xảy.
5.3.1.5.2 Tiến hành phản ứng
Huyết thanh vô hoạt ở 58 0C/50 min (trong bồn nước ấm), sau đó pha loãng với dung dịch VB ở hiệu giá 1:4.
Mỗi mẫu huyết thanh cần 7 ống nghiệm: 6 ống để pha loãng, 1 ống đối chứng huyết thanh kháng bổ thể. Cho 0,25 ml dung dịch VB vào tất cả các ống trừ ống số 1.
Cho 0,25 ml mẫu huyết thanh 1:4 vào ống 1, ống 2 và ống 7.
Pha loãng mẫu huyết thanh từ ống 2 đến ống 6 bằng cách trộn đều dung dịch trong ống 2 sau đó hút 0,25 ml chuyển sang ống 3, trộn đều và hút 0,25 ml chuyển tiếp... cho tới ống 6 thì hút bỏ 0,25 ml. Như vậy từ ống 1 cho tới ống 6 chứa 0,25 ml mẫu huyết thanh với độ pha loãng lần lượt là: 1/4, 1/8,… 1/128, ống số 7 sẽ là ống đối chứng huyết thanh kháng bổ thể.
Cho 0,25 ml kháng nguyên chuẩn vào các ống từ 1 đến 6 và 0,25 ml dung dịch VB vào ống 7. Cho 0,25 ml bổ thể 1,25 MHD vào tất cả các ống.
Đem ủ qua đêm (từ 18 h đến 20 h) ở 4 0C hoặc ủ ấm ở 37 0C trong 30 min. Nếu ủ qua đêm thì trước khi đem làm tiếp phải cho vào nồi cách thủy ở 37 0C trong khoảng 10 min.
Lấy 3 ống nghiệm khác làm ống đối chứng bổ thể.
Ống 1 cho 0,25 ml bổ thể 1,25 MHD, ống 2 là 0,25 ml bổ thể 1,25 MHD với 0,25 ml dung dịch VB (pha loãng 2 lần), ống 3 chứa 0,25 ml bổ thể 1,25 MHD + 0,75 ml dung dịch VB (pha loãng 4 lần). Như vậy ống 1 chứa 2 đơn vị bổ thể, ống 2 chứa 1 đơn vị bổ thể, ống 3 chứa 0,5 đơn vị bổ thể.
Cho 0,5 ml dung dịch VB vào cả 3 ống.
Để tất cả 10 ống trên vào nồi cách thủy 370C trong 30 min hoặc 40C trong 14 h đến 18 h (phương pháp cố định lạnh). Khi lấy ra khỏi tủ lạnh phải để ở nhiệt độ phòng 10 min.
CHÚ Ý: Phải có một mẫu đối chứng dương (dùng huyết thanh dương tính chuẩn có độ dương tính thấp) được tiến hành song song với mẫu kiểm tra và cách làm tương tự như với mẫu huyết thanh.
Chuẩn bị “hệ thống dung huyết” bằng cách trộn 1 phần hồng cầu cừu 3 % với 1 phần dung huyết tố 5 MHD. Lắc nhẹ để trộn đều, để ở nhiệt độ phòng trong 15 min và thỉnh thoảng lại lắc nhẹ lên.
Khi thời gian ủ đã hết thì cho 0,25 ml “hệ thống dung huyết” vào mỗi ống, trộn đều và ủ ấm ở 37 0C từ 30 min đến 1 h. Cứ 10 min lắc 1 lần.
Khi hết thời gian phản ứng tiến hành đọc kết quả. Tiến hành trên đĩa 96 lỗ đáy chữ U:
Cho 25 µl dung dịch VB vào các giếng (từ B đến H). Cho 25 µl mẫu huyết thanh 1:4 vào giếng A, B và G.
Pha loãng mẫu từ giếng B đến F sau đó thì bỏ đi 25 µl. Pha loãng mẫu huyết thanh trong giếng G sang H rồi bỏ đi 25 µl (2 giếng G, H để làm đối chứng huyết thanh kháng bổ thể).
Thêm 25 µl kháng nguyên 1:30 vào các giếng từ A đến F, 25 µl dung dịch VB vào các giếng G, H. Lặc đĩa một cách nhẹ nhàng và giữ ở nhiệt độ phòng.
Thêm 25 µl bổ thể 1,25 MHD vào tất cả các giếng từ A đến H.
Lắc nhẹ đĩa và ủ qua đêm (từ 18 h đến 20 h) ở 4 0C hoặc ủ ấm ở 37 0C trong 1 h.
Chuẩn bị “hệ thống dung huyết” bằng cách trộn 1 phần hồng cầu cừu 3 % với 1 phần dung huyết tố 5 MHD. Lắc nhẹ để trộn đều, để ở nhiệt độ phòng trong 15 min và thỉnh thoảng lại lặc nhẹ lên.
Khi thời gian ủ đã hết thì cho 25 µl “hệ thống dung huyết” vào tất cả các giếng từ A đến H, trộn đều và ủ ấm trong ở 370 C từ 30 min đến 1 h. Cứ 10 min lắc một lần.
Khi hết thời gian phản ứng thì tiến hành đọc kết quả.
5.3.1.5.3 Đánh giá kết quả
Không có dung huyết (ngưng kết) phản ứng được đánh dấu ++++, dung huyết ít hơn (ngưng kết ít hơn) +++ …, dung huyết hoàn toàn (không ngưng kết) đánh dấu (-). Phản ứng được đọc ở độ pha loãng cao nhất mà tại đó phản ứng vẫn xảy ra.
Ống đối chứng huyết thanh kháng bổ thể phải dung huyết hoàn toàn.
Các ống đối chứng bổ thể sẽ dung huyết hoàn toàn ở ống 1 và ống 2 hoặc ++ hoặc +++ ở ống 3. Độ nhạy của phản ứng phải được kiểm tra bằng cách kiểm tra phản ứng của ống kháng huyết thanh chuẩn.
0: không kết hợp (không ngưng kết) (100 % dung huyết)
+ : 25 % kết hợp (75 % dung huyết)
++ : 50 % kết hợp (50 % dung huyết)
+++ : 75 % kết hợp (25 % dung huyết).
++++ : 100 % kết hợp (không dung huyết).
Đối với phương pháp cố định ở 37 0C:
- Hiệu giá 1:4: dương tính hoặc nghi ngờ.
- Hiệu giá 1:8 hoặc lớn hơn: dương tính. Phương pháp cố định lạnh:
- Hiệu giá 1:8: nghi ngờ.
- Hiệu giá 1:16 hoặc lớn hơn: dương tính.
5.3.1.5 Kết luận
Kiểm tra toàn đàn gia súc và kiểm tra định kỳ dùng phương pháp Rose Bengal, phương pháp ngưng kết trong ống nghiệm, phương pháp ELISA, phương pháp vòng sữa.
Để kết luận có bệnh sảy thai truyền nhiễm trong đàn dùng phương pháp CFT và có thể phân lập (tùy điều kiện của từng phòng thí nghiệm).
Đàn đó tiêm phòng phải dùng phương pháp ELISA kết hợp với phương pháp CFT.
5.3.2 Phát hiện kháng nguyên
5.3.2.1 Kiểm tra bằng kính hiển vi
5.3.2.1.1 Phết và cố định tiêu bản
Bệnh phẩm lấy từ tổ chức (thai bị sảy, nhau thai, lách, hạch vú, hạch vùng xoang chậu): cắt một miếng nhỏ, phiết lên phiến kính sạch, để khô.
Bệnh phẩm lấy từ các dịch tiết (nước ối, dịch nhờn âm hộ, sữa, máu, tinh dịch): lấy một giọt nhỏ lên phiến kính sạch sau đó dàn mỏng đều bằng phiến khác, để khô.
Cố định tiêu bản: dùng cồn Methanol nhỏ ngập tiêu bản, để khô rồi đem nhuộm.
5.3.2.1.2 Nhuộm tiêu bản
Có thể nhuộm theo phương pháp Gram hoặc phương pháp Ziehl - Neelsen (xem Phụ lục B)
5.3.2.1.3 Quan sát hình thái vi khuẩn
Tiêu bản sau khi nhuộm để khô, xem trên kính hiển vi với độ phóng đại 100. Nếu bệnh phẩm có Brucella sẽ thấy:
Vi khuẩn bắt màu hồng (màu của vi khuẩn Gram âm) khi nhuộm bằng phương pháp nhuộm Gram. Vi khuẩn sẽ bắt màu đỏ trên nền xanh da trời nhuộm bằng phương pháp Ziehl - Neelsen.
Là cầu trực khuẩn nhỏ hoặc đa hình thái (hình trứng, hình gậy,…). Chúng thường nằm dải rác thành những tế bào đơn như những hạt cát mịn đôi khi tập trung thành từng cắp hoặc chuỗi nhỏ.
Kích thước của Brucella vào khoảng (từ 0,5 µm đến 0,7 µm) x (từ 0,6 µm đến 1,5 µm), không hình thành nha bào và giáp mô.
5.3.2.2 Phân lập vi khuẩn
5.3.2.2.1 Yêu cầu chung
Phương pháp này ít áp dụng do thời gian quá dài (từ 10 ngày đến 2 tháng) nhưng khi bắt buộc phân lập cần phải chú ý đến các biện pháp an toàn sinh học vì đây là bệnh lây sang người.
5.3.2.2.2 Chuẩn bị mẫu và môi trường
Sữa: cho vào ống kín đem ly tâm ở 2000 g trong 15 min. Hớt bỏ váng sữa vào dung dịch sát trùng (tránh bị xáo trộn lớp kem). Lớp kem còn lại và lớp chất lắng dưới đáy được trộn lẫn với nhau.
Máu: dùng để cấy vào môi trường lỏng là chủ yếu. Lấy khoảng 10 ml máu vào xi lanh hoặc ống đựng mẫu chân không.
Môi trường cơ bản: Có thể sử dụng các môi trường sau đây để phân lập Brucella: thạch TSA, thạch máu, thạchColumbia.
CHÚ THÍCH 1: Việc phân lập và nuôi cấy vi khuẩn Brucella được thực hiện chủ yếu trên môi trường thạch. Đây là dạng môi trường tốt nhất để vi khuẩn phát triển một cách thuần khiết và hạn chế khả năng tạp nhiễm vi khuẩn khác. Tuy nhiên cũng có thể sử dụng các môi trường lỏng để phân lập vi khuẩn với những mẫu là tổ chức hoặc cho mục đích làm giàu vi khuẩn.
Những loại môi trường trên thường được bổ sung từ 2 % đến 5 % huyết thanh trâu, bò hoặc ngựa.
Các môi trường chuyên biệt khác như thạch huyết thanh-dextroza (SDA - serum-dextrose agar) để quan sát hình thái học vi khuẩn hoặc thạch glycerol dextroza (glycerol dextrose agar).
5.3.2.2.3 Tiến hành
Cấy bệnh phẩm vào môi trường và ủ ấm ở 37 0C trong tủ ấm CO2 với 5 % đến 10 % khí trong thời gian từ 1 tuần đến 2 tháng. Nếu có vi khuẩn, trên mặt thạch sẽ hình thành những khuẩn lạc tròn cong lồi, trong suốt, mặt nhẵn, rìa gọn, nhuộm bắt màu Gram âm và vi khuẩn có dạng cầu trực khuẩn hoặc hình gậy ngắn.
5.3.2.2.4 Đọc kết quả
Các đặc trưng của các loài Brucella:
Loài | Hình thái khuẩn lạc | Sản sinh H2S | Phản ứng oxidase | Phản ứng urease |
B. abortus | S | + | + | + |
B. suis | S | - | + | + |
B. melitensis | S | - | + | + |
B. ovis | R | - | - | - |
B. canis | R | - | - | + |
B. neotomae | S | + | + | + |
CHÚ THÍCH: S: khuẩn lạc nhẵn, R: khuẩn lạc nhám. |
|
|
|
|
5.3.2.3 Giám định sinh hoá và định typ huyết thanh - Phản ứng oxidase (xem Phụ lục C).
- Phản ứng urease dương tính (xem Phụ lục C).
- Nếu phân lập được vi khuẩn, đem thử lại bằng phản ứng ngưng kết với kháng huyết thanh đặc hiệu của từng chủng riêng biệt và làm các phản ứng sinh hóa.
PHỤ LỤC A
(Quy định)
THÀNH PHẦN VÀ CHUẨN BỊ DUNG DỊCH THUỐC THỬ
A.1 Dung dịch EDTA-PBS pH 7,2
Natri clorua (NaCl) 8,0 g
Kali clorua (KCl) 0,20 g
Dinatri hydrophosphat (Na2HPO4) 1,15 g
Kali dihydrophosphat (KH2PO4) 0,20 g
EDTA 3,72 g
Nước 1 000 ml
PHỤ LỤC B
(Quy định)
CÁC PHƯƠNG PHÁP NHUỘM
B.1 Phương pháp nhuộm Ziehl-Neelsen
Bước 1: Hơ tiêu bản đã được cố định bằng lửa
Bước 2: Nhỏ ngập tiêu bản bằng Carbol Fuchsin. Hãy đảm bảo thuốc nhuộm luôn được phủ kín trong suốt quá trình nhuộm.
Bước 3: Sử dụng đèn Bun-sen (đèn khí đốt hình ống như dùng trong phòng thí nghiệm), làm nóng tiêu bản một cách từ từ cho tới khi nóng và duy trì trong 5 min bằng cách sử dụng nhiệt độ thấp hoặc làm nóng gián đoạn.
CHÚ Ý: Nếu hơ lửa quá nóng có thể làm vỡ phiến kính. Bước 4: Rửa tiêu bản bằng nước.
Bước 5: Nhỏ ngập tiêu bản với axit-alcohol 3 % trong 5 min (tẩy màu). Trong 5 min đó, có thể nhỏ thêm axit-alcohol 3 % cho tới khi tiêu bản được tẩy sạch.
Bước 6: Rửa sạch tiêu bản với nước và sau đó làm khô tiêu bản.
Bước 7: Nhỏ ngập tiêu bản bằng phẩm màu xanh metylen và giữ trong khoảng 1 min.
Bước 8: Rửa sạch tiêu bản bằng nước. Toàn bộ các bước được thực hiện đúng và chính xác, kiểm tra dưới kính hiển vi với vật kính dầu thấy vi khuẩn bắt màu đỏ trên nền xanh da trời.
B.2 Phương pháp nhuộm Gram
Bước 1: Nhỏ ngập tiêu bản đã cố định bằng dung dịch tím tinh thể trong 1 min. Rửa sạch tiêu bản nhanh dưới vòi nước (không quá 5 s). Lau khô.
Bước 2: Nhỏ ngập tiêu bản bằng dung dịch Gam's Iodine (dung dịch iôt 2 % và kali iôt 3 % trong cồn 70 %) trong khoảng 1 min. Rửa sạch tiêu bản dưới vòi nước. Lau khô.
Bước 3: Nhỏ ngập tiêu bản với cồn 95 % trong 10 s (có thể lâu hơn nếu tiêu bản bắt màu quá đậm) và rửa sạch bằng vòi nước. Lau khô tiêu bản.
Bước 4: Nhỏ ngập tiêu bản bằng dung dịch hữu cơ màu đỏ trong 30 s. Rửa sạch dưới vòi nước. Lau khô tiêu bản bằng giấy thấm nước nhưng không làm bay mất lớp cố định.
Bước 5: Kiểm tra tiêu bản dưới kính hiển vi với vật kính dầu.
PHỤ LỤC C
(Quy định)
CÁC PHẢN ỨNG SINH HOÁ
C.1 Phân giải urê
Có thể sử dụng môi trường urê cơ bản (urea agar base - Christensen) (chuẩn bị môi trường và bổ sung urê theo chỉ dẫn của nhà sản xuất).
Cấy vi khuẩn vào môi trường có urê, nuôi cấy ở 37 0C, sau 24 h đọc kết quả. - Phản ứng âm tính: môi trường không thay đổi màu.
- Phản ứng dương tính: môi trường chuyển màu tím.
C.2 Phản ứng oxidaza
Phản ứng được tiến hành trên giấy có tẩm dung dịch 1 % tetra methyl p-phenyl diamin HCl. Dùng que cấy lấy khuẩn lạc từ môi trường thạch chà sát lên trên mặt giấy. Phản ứng dương tính khi xuất hiện màu đen tím sau 30 s. Phản ứng âm tính khi giấy tẩm giữ nguyên màu.
PHỤ LỤC D
(Quy định)
CHUẨN ĐỘ CÁC DUNG DỊCH CỦA PHƯƠNG PHÁP CFT
D.1 Chuẩn độ kháng nguyên Brucella
Cho 50 ml nước muối sinh lý vào tất cả các lỗ của đĩa nhựa 96 giếng chữ U. Cho 50 ml huyết thanh dương pha loãng 1/ 2,5 vào các lỗ cột 1.
Pha loãng từ cột 1 đến cột 12 bằng cách trộn đều và hút 50 ml ở cột 1 cho vào cột 2, tiếp tục trộn đều và hút từ cột 2 sang cột 3…. hút bỏ 50 l ở cột 12.
Dùng 8 ống nghiệm pha loãng kháng nguyên cần kiểm tra bắt đầu từ hiệu giá 1/ 2,5 fi 1/ 5 fi 1/10 … fi 1/320
Cho 50 ml kháng nguyên ở ống 8 vào các lỗ ở hàng H, ống 7 vào hàng G, ống 6 vào hàng F… ống 1 vào hàng A, trộn đều và ủ ấm 37 0C qua đêm.
Đọc kết quả: Nếu ở độ huyết thanh pha loãng nhất vẫn ngưng kết với các nồng độ kháng nguyên khác nhau thì bất cứ nồng độ kháng nguyên nào trong khoảng đó đều có thể chọn làm nồng độ chuẩn cho phản ứng. Thông thường chọn độ pha loãng hơi đậm hơn so với độ pha loãng cao nhất của kháng nguyên làm dung dịch kháng nguyên chuẩn cho chẩn đoán.
VÍ DỤ: Ở độ pha loãng huyết thanh 1/1280, tất cả các nồng độ pha loãng kháng nguyên từ 1/5 fi 1/40 đều cho phản ứng ngưng kết, nên chọn độ pha loãng 1/30 của kháng nguyên làm dung dịch chuẩn.
D.2 Chuẩn độ dung huyết tố
Pha loãng dung huyết tố ở nồng độ 1/10 ( (0,1 dung huyết tố + 0,9 ml VBS). Từ nồng độ 1/10, pha một dãy các nồng độ khác nhau như sau:
Ống | Độ pha loãng | Dung huyết tố | VBS, ml |
1 | 1/100 | 0,2 của nồng độ 1/10 | 1,8 |
2 | 1/250 | 0,2 của nồng độ 1/100 | 0,3 |
3 | 1/500 | 0,4 của nồng độ 1/100 | 1,6 |
4 | 1/750 | 0,2 của nồng độ 1/100 | 1,3 |
5 | 1/1000 | 0,2 của nồng độ 1/100 | 1,8 |
6 | 1/1500 | 0,2 của nồng độ 1/500 | 0,4 |
7 | 1/2000 | 0,2 của nồng độ 1/500 | 0,6 |
8 | 1/2500 | 0,2 của nồng độ 1/500 | 0,8 |
9 | 1/3000 | 0,2 của nồng độ 1/1000 | 0,4 |
10 | 1/4000 | 0,2 của nồng độ 1/1000 | 0,6 |
11 | 1/5000 | 0,2 của nồng độ 1/1000 | 0,8 |
12 | 1/6000 | 0,2 của nồng độ 1/1000 | 1,0 |
Chuyển 30 ml của mỗi nồng độ pha loãng dung dịch dung huyết tố sang một dãy ống nghiệm tương ứng. Thêm 30 ml của hỗn dịch hồng cầu cừu (SRBC) 3 %.
Trộn đều và đặt vào nồi chưng cách thuỷ đun nóng tới 37 0C trong 1 h cùng máy lắc. Cho vào đĩa 96: 25 ml bổ thể 1/10 và 50 ml VBS.
Trộn đều và thêm 50 ml dung dịch chứa dung huyết tố và hồng cầu cừu (pha loãng theo các nồng độ), trộn và đặt vào tủ ấm 37 0C trong 30 min (sau mỗi 15 min bỏ ra trộn một lần và lại đặt vào tủ ấm), sau 30 min lấy ra khỏi tủ ấm và lại trộn đều.
Đánh giá kết quả chuẩn độ dung huyết tố.
VÍ DỤ: Từ lỗ 1 đến lỗ 9 có nhiều dung huyết tố làm tan hết hồng cầu cừu. Từ lỗ 10 đến lỗ 12 ít dung huyết tố do đó không tan hết hồng cầu cừu. Do vậy, lấy lỗ thứ 8 vì tại lỗ thứ 8 hồng cầu cừu tan hết. Lỗ thứ 8 tương ứng với độ pha loãng 1/2500 = MHD (Minimum Haemolytic Dose - liều tối thiểu gây dung huyết), làm phản ứng cần 5 MHD, do đó:
1/2500 x 5 = 1/500 (lấy haemolysin ở nồng độ pha loãng 1/500 để làm phản ứng).
D.3 Chuẩn độ bổ thể
Bổ thể pha loãng ở nồng độ 1/10 (0,5 ml bổ thể + 4,5 ml dung dịch muối đệm Veronal). Từ nồng độ pha loãng 1/10 tiến hành pha loãng một dãy bổ thể như sau:
Ống | Độ pha loãng | Bổ thể 1/10 | Dung dịch muối đệm Veronal (ml) |
1 | 1/20 | 0,2 ml | 0,2 |
2 | 1/30 | 0,2 ml | 0,4 |
3 | 1/40 | 0,2 ml | 0,6 |
4 | 1/50 | 0,2 ml | 0,8 |
5 | 1/60 | 0,2 ml | 1,0 |
6 | 1/70 | 0,2 ml | 1,2 |
7 | 1/80 | 0,2 ml | 1,4 |
8 | 1/90 | 0,2 ml | 1,6 |
9 | 1/100 | 0,2 ml | 1,8 |
10 | 1/120 | 0,2 ml | 2,2 |
11 | 1/150 | 0,2 ml | 2,8 |
Lấy 25 ml (1 giọt) của mỗi nồng độ bổ thể pha loãng cho vào một dãy 11 lỗ của đĩa nhựa 96 lỗ (microtitre plate). Cho 25 ml dung dịch muối đệm Veronal vào lỗ 12 (được coi là đối chứng).
Thêm 25 ml dung dịch muối đệm Veronal vào tất cả các lỗ.
Trộn đều và đặt vào tủ ấm 37 0C trong 30 min.
Thêm 25 ml hệ thống dung huyết vào tất cả các lỗ. Trộn đều và đặt vào tủ ấm 370C trong 30 min.
Để ở nhiệt độ phòng một số thời gian (hoặc đặt trong tủ lạnh một đêm) trước khi đọc kết quả. Đánh giá kết quả chuẩn độ bổ thể:
Âm tính: 100 % dung huyết (không có sự kết hợp).
+: 75 % dung huyết, 25 % có sự kết hợp.
+: 50 % dung huyết, 50 % có sự kết hợp.
+++: 25 % dung huyết, 75 % có sự kết hợp.
++++: không có hiện tượng dung huyết.
Kết quả chuẩn độ bổ thể:
Lỗ | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 |
Độ pha loãng | 1/20 | 1/30 | 1/40 | 1/50 | 1/60 | 1/70 | 1/80 | 1/90 | 1/100 | 1/120 | 1/150 | Đối chứng |
Kết quả | - | - | - | - | + | + | + |
|
|
|
|
|
Từ bảng trên: 1 MHD = 1/60 pha loãng bổ thể.
Sử dụng trong phản ứng dùng:
(1 + 1/4) MHD = 5/4 x 1/60 = 1/48 pha loãng bổ thể.