Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 8686-6:2011 về thuốc thú y - Phần 6:Paracetamol và axit ascorbic dạng bột
TIÊU CHUẨN VIỆT NAM
TCVN 8686-6:2011
THUỐC THÚ Y – PHẦN 6: PARACETAMOL VÀ AXIT ASCORBIC DẠNG BỘT
Veterinary drugs - Part 6: Powder paracetamol and acid ascorbic
1. Phạm vi áp dụngTiêu chuẩn này áp dụng cho thuốc paracetamol và axit ascorbic dạng bột dùng trong thú y.
2. Tài liệu viện dẫnCác tài liệu viện dẫn sau rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
Dược điển Việt Nam IV trang 12, 462.3. Yêu cầu kỹ thuật
3.1 Công thức pha chế
Paracetamol 0,75 gAxit ascorbic 0,50 g
Lactose vừa đủ 8,00 g.
3.2 Nguyên liệu
Paracetamol Theo tiêu chuẩn của nhà sản xuất.Axit ascorbic Theo tiêu chuẩn của nhà sản xuất.
Lactose Đạt tiêu chuẩn Dược điển Việt Nam IV.3.3 Chất lượng thành phẩm
3.3.1 Yêu cầu cảm quanChỉ tiêu | Yêu cầu |
| Màu sắc | Màu trắng |
| Trạng thái | Dạng bột |
Chỉ tiêu | Yêu cầu |
| Hàm lượng | 100 % (± 10 %) |
4. Lấy mẫu
4.1 Nguyên tắc chung lấy mẫuLấy mẫu theo nguyên tắc ngẫu nhiên.
Lượng thuốc trong mẫu phân tích cũng như trong mẫu lưu ít nhất phải đủ cho ba lần phân tích hoặc phải đủ để thực hiện các phép thử đảm bảo thu được kết quả chính xác và tin cậy. Lượng thuốc này được tính toán trên cơ sở tiêu chuẩn phương pháp thử của sản phẩm. Bình thường mỗi lô sản xuất được lấy hai mẫu (một mẫu phân tích và một mẫu lưu).
Trường hợp đặc biệt, số mẫu phân tích và mẫu lưu có thể nhiều hơn hai để đủ gửi kiểm nghiệm và lưu ở nhiều nơi nếu xét thấy cần thiết.4.2 Lấy mẫu thành phẩm
Mẫu được lấy tại những vị trí khác nhau của lô sản xuất, không được phá lẻ các đơn vị đóng gói sản phẩm để lấy mẫu. Từ các đơn vị lấy mẫu được tập hợp lại thành mẫu chung và mẫu cuối cùng.Số lượng mẫu thành phẩm cần lấy được qui định cụ thể dưới đây
Quy cách đóng gói (g) | Số lượng mẫu lấy (đơn vị bao gói) |
| Cho tới 2 | 70 |
| Từ 2 đến dưới 5 | 30 |
| Từ 5 đến dưới 50 | 7 |
| Từ 50 đến dưới 100 | 4 |
| Từ 100 trở lên | 3 |
5. Phương pháp thử
5.1 Kiểm tra cảm quanTiến hành kiểm tra cảm quan sản phẩm bằng mắt thường.
5.2 Phương pháp xác định hàm lượng hoạt chất chính
5.2.1 Thuốc thử5.2.1.1 Paracetamol và axit ascorbic chuẩn.
5.2.1.2 Axetonitril (tinh khiết sắc ký).5.2.1.3 Ethanol 960 (tinh khiết phân tích).
5.2.1.4 KH2PO4 (tinh khiết phân tích).5.2.1.5 H3PO4 (tinh khiết phân tích).
5.2.1.6 Nước cất.5.2.2 Thiết bị, dụng cụ
5.2.2.1 Máy sắc ký lỏng hiệu năng cao (HPLC-UV-vis).5.2.2.2 Cột Lichrosorb RP 18 (250 x 4mm; 10 mm).
5.2.2.3 Máy lắc siêu âm.5.2.2.4 Giấy lọc, cỡ lỗ 0,45 mm.
5.2.2.5 Cân phân tích, có thể cân chính xác đến 0,1 mg.5.2.2.6 Bình định mức, dung tích 50 ml, 100 ml và 1000 ml.
5.2.2.7 Pipét, dung tích 5 ml.5.2.3 Phương pháp xác định
5.2.3.1 Phương pháp định tínhThời gian lưu của paracetamol và axit ascorbic trong mẫu thử trùng với thời gian lưu của paracetamol và axit ascorbic chuẩn.
5.2.3.2 Phương pháp định lượng5.2.3.2.1 Chuẩn bị pha động
Đệm phosphat: cân 2,72 g KH2PO4 hoà tan trong 1 000 ml nước cất, sau đó chỉnh pH của dung dịch này đến 2,3 bằng dung dịch H3PO4 85 %.Pha động chạy máy: đệm phosphat/Axetonitril với tỷ lệ 85:15 (phần thể tích).
Dung môi pha mẫu: ethanol:nước tỷ lệ 1:1 (phần thể tích).5.2.3.2.2 Điều kiện sắc ký
- Tốc độ dòng: 1,5 ml/min.- Detector tử ngoại với bước sóng 265 nm.
- Thể tích bơm 20 ml.Tiến hành đo riêng mẫu chuẩn và mẫu thử trên máy HPLC, ghi diện tích mẫu chuẩn và mẫu thử.
5.2.3.2.3 Dung dịch chuẩn5.2.3.2.3.1 Dung dịch paracetamol chuẩn
Cân 0,05 g paracetamol cho vào bình định mức 50 ml hoà tan bằng dung môi, lắc đều.Sau đó lấy 5 ml dung dịch này cho vào bình định mức 50 ml, thêm dung môi vừa đủ, lắc đều. Lọc qua giấy lọc 0,45 mm
5.2.3.2.3.2 Dung dịch axit ascorbic chuẩnCân 0,075 g axit ascorbic chuẩn cho vào bình định mức 50 ml, thêm dung môi vừa đủ rồi lắc đều.
Sau đó lấy 5 ml dung dịch này cho vào bình định mức 100 ml, thêm dung môi vừa đủ rồi lắc đều.Lọc qua giấy lọc 0,45 mm.
5.2.3.2.3.2 Dung dịch thửCân 0,1067 g thuốc cho vào bình định mức 100 ml.
Thêm dung môi vừa đủ, lắc đều.Lắc siêu âm, lọc qua giấy lọc 0,45 mm.
5.3.3.1.2.5 Tính kết quảDựa vào diện tích pic chuẩn và pic thử để tính hàm lượng chất chính theo công thức sau:
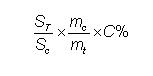
ST là diện tích pic của mẫu thử.
SC là diện tích pic của mẫu chuẩn.mc là khối lượng chất chuẩn, tính bằng gam (g);
mt là khối lượng chất cần thử, tính bằng gam (g);C% là hàm lượng chất chuẩn.
6. Bao gói, bảo quản và vận chuyểnThuốc được đóng trong chai, lọ kín để nơi khô mát, tránh ánh sáng.