Nội dung toàn văn Tiêu chuẩn ngành 10 TCN 815:2006 về quy trình chẩn đoán bệnh dịch tả vịt
TIÊU CHUẨN NGÀNH
10 TCN 815:2006
QUY TRÌNH CHẨN ĐOÁN BỆNH DỊCH TẢ VỊT
Protocol for duck virus enteritis diagnosis
1. Phạm vi áp dụng:
Quy trình này được áp dụng để chẩn đoán bệnh Dịch tả vịt tại các phòng thí nghiệm chẩn đoán bệnh động vật.
2. Khái niệm
- Bệnh Dịch tả vịt (Duck Virus Enteritis ) là bệnh truyền nhiễm cấp tính nguy hiểm xảy ra ở vịt, ngan, ngỗng các lứa tuổi.
- Nguyên nhân gây bệnh do herpes virus.
3. Lấy mẫu:
3.1. Lấy mẫu:
Mẫu bệnh phẩm lấy từ vịt nghi mắc bệnh là:
- Gan, lách, thận (đối với vịt chết lấy mẫu trong vòng 24h).
- Huyết thanh.
3.2. Bảo quản và gửi mẫu bệnh phẩm
- Mẫu được lấy ngay sau khi mổ khám.
- Mẫu được lấy vào lọ hoặc túi nylon sạch.
- Dán nhãn.
- Bảo quản mẫu ở nhiệt độ 4-8oC.
- Có phiếu gửi bệnh phẩm.
4. Máy móc - Dụng cụ - Hoá chất - Nguyên liệu
4.1. Máy móć:
- Tủ lạnh âḿ: -15 đến -20oC.
- Tủ lạnh thường: +2 đến +8oC.
- Tủ ấm.
- Tủ ấm CO2.
- Máy lắc đĩa (orbital shaker).
- Máy lắc trộn (vortex mixer).
- Máy khuấy từ.
- Nồi đun cách thuỷ (water bath).
- Buồng cấy BSC (Bio-safety cabinet).
- Máy ly tâm.
- Máy hút chân không.
- Đèn soi trứng.
- Tủ ấp trứng.
4.2. Dụng cụ:
- Bình tam giác các cỡ: 100, 200, 500 và 1000 ml.
- ống đong thuỷ tinh các cỡ: 50, 100, 200, 500 và 1000 ml.
- Cốc có mỏ các cỡ: 100, 200, 500 và 1000 ml.
- ống nghiệm.
- Lọ nhỏ chắt huyết thanh.
- Pipet thuỷ tinh: 1, 5 và 10 ml.
- Micropipet đơn: 0,5-10, 5-40, 40-200, 200-1000 ml.
- Micropipet nhiều đầu (8-12): 5-50, 50-300 ml.
- Cối chày sứ.
- Khăn bông.
- Dao, kéo, panh kẹp.
- Khuấy từ.
- Dụng cụ nuôi cấy tế bào: lọ nhựa T25, đĩa nhựa 96 lỗ, đĩa nuôi cấy 6 lỗ, 24 lỗ.
- Màng lọc Millipor 0,45mm.
- Đĩa petri.
4.3. Hoá chất (hóa chất phân tích tinh khiết dành cho phòng thí nghiệm)
- Nước cất hoặc nước khử ion.
- NaCl.
- KCl.
- Na2HPO4.
- KH2PO4.
- NaHCO3
- Chloroform.
- Tris/HCl
- EDTA
- Hoá chất để tiêu độc, tiệt trùng: Formalin, Chloramin.
4.4. Nguyên liệu:
- Môi trường nuôi cấy tế bào:
+ L-glutamine
+ TPB – Tryptose Photphat Broth
+ Trypsine
+ Eagle’s minimum essential medium (MEM)
+ Tryptose Photphat Broth (TPB)
+ Fetal calf serum (FCS).
- Kháng sinh: Penicillin, Streptomycin, Kanamycin.
- Vịt con 1-7 ngày tuổi.
- Trứng vịt có phôi (11-12 ngày tuổi).
- Trứng vịt có phôi (9-10 ngày tuổi): dùng để làm tế bào xơ phôi vịt (DEF – Duck Embryo Fibroblast).
- Giống virus Dịch tả vịt.
- Kháng huyết thanh Dịch tả vịt.
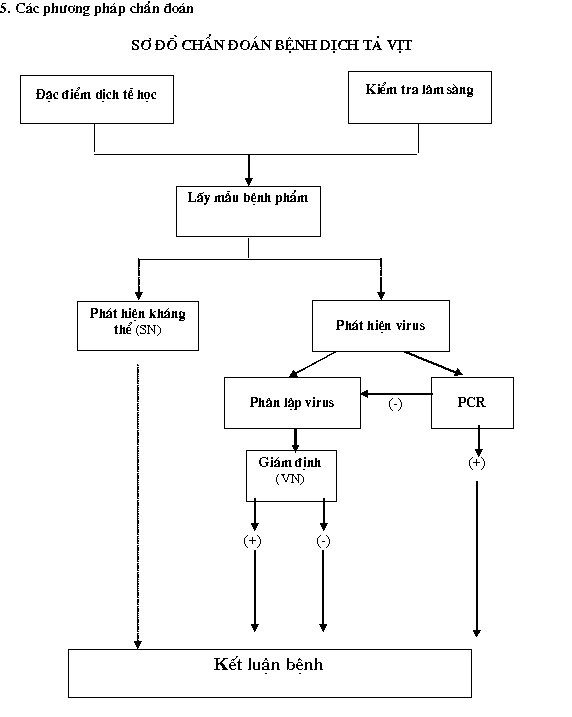
5.1. Kiểm tra một số đặc điểm dịch tễ học – triệu chứng:́́
- Tìm hiểu bệnh sử và truyền lây của bệnh như:
+ Bệnh xảy ra ở vịt, ngan, ngỗng mọi lứa tuổi.
+ Bệnh lây lan nhanh và trầm trọng trong khoảng 2-3 ngày.
- Kiểm tra triệu chứng:
+ Giảm ăn, mất thăng bằng, ỉa phân loãng, xù lông.
+ Mắt có dử, mí mắt sưng, sợ ánh sáng, chảy nước mũi.
5.2 Kiểm tra bệnh tích:
- Kiểm tra bệnh tích đại thể:
+ Ở vịt trưởng thành có hiện tượng gan bị bạc màu. ở con đực trưởng thành có thể xảy ra hiện tượng dương vật bị thay đổi vị trí, ở con cái quan sát thấy các nang trứng bị xuất huyết.
+ Mạch máu bị tổn thương, tổn thương hệ bạch huyết, thoái hoá nhu mô. ống tiêu hoá có nhiều chất nhờn. Đây là đặc trưng của bệnh Dịch tả vịt.
- Kiểm tra bệnh tích vi thể:
+ Tổn thương mạch máu và các cơ quan phủ tạng. Xuất hiện các thể vùi nội nhân, thể vùi tế bào chất trong các tế bào biểu mô của hệ thống tiêu hoá. Đây là bệnh tích đặc trưng của bệnh.
5.3. Chẩn đoán phòng thí nghiệm
5.3.1. Phát hiện virus:
Xử lý bệnh phẩm:
- Mẫu gan, lách, thận được xử lý thành huyễn dịch 10% với PBS có chứa 200 UI/ml Penicillin và 200mg/ml Streptomycin.
- Ly tâm 2.000 vòng/15ph.
- Lấy dịch trong ở trên.
- Kiểm tra vô trùng: trên môi trường nước thịt BHI, hoặc môi trường thạch máu.
5.3.1.1. Phân lập virus:
a. Phân lập trên trứng vịt có phôi:
- Tiêm 0,2ml huyễn dịch bệnh phẩm đã xử lý vào xoang niệu mô hoặc màng CAM phôi vịt 11-12ngày: 5 phôi/mẫu bệnh phẩm.
- Trứng được ấp tiếp ở tủ ấp 37oC.
- Soi trứng. Loại bỏ những phôi chết trong khoảng 24h sau khi tiêm.
- Virus DTV gây chết phôi sau 4-10 ngày với đặc trưng: Xuất huyết lan rộng.
- Thu hoạch gan phôi và nước niệu để giám định virus.
b. Phân lập trên tế bào xơ phôi vịt (Duck Embryo Fibroblast – DEF):
- Cấy tế bào DEF trên các lọ nuôi cấy T25 hoặc đĩa nuôi cấy ( đĩa nuôi cấy 6 lỗ, 24 lỗ), sau 2-3 ngày tế bào mọc thành thảm (khoảng 70%) thì gây nhiễm huyễn dịch bệnh phẩm đã xử lý: 500µl/lỗ hoặc lọ. Việc cấy chuyển 2 lần là cần thiết trong qúa trình phân lập.
- Quan sát bệnh tích tế bào (CPE-Cytopathic pathogene effect): đặc trưng với đám tế bào to, tròn và trở nên hoại tử sau 2-4 ngày sau đó.
- Thu hoạch hỗn dịch tế bào, đông tan, ly tâm và thu phần nước trong cho giám định virus.
5.3.1.2. Phương pháp giám định virus
a. Phương pháp trung hoà trên trứng vịt có phôi (VN - Virus Nertralization):
(phôi vịt 10-14 ngày tuổi).
- Chuẩn bị:
+ Pha loãng virus phân lập: Nồng độ 10-1–10-9 với dung dịch PBS.
+ Lô đối chứng (+): Trộn kháng huyết thanh dương tính DTV với các nồng độ virus đã pha loãng theo tỷ lệ 1:1.
+ Lô đối chứng (-): Trộn huyết thanh (-) tính với các nồng độ virus đã pha loãng theo tỷ lệ 1:1.
+ Ủ hỗn hợp trên ở nhiệt độ 37oC/1h.
- Tiến hành:
+ Tiêm hỗn hợp trên vào xoang niệu mô phôi trứng (0,2ml/phôi), 5 phôi/nồng độ.
+ Phôi được ấp tiếp ở tủ ấp 37oC trong 10 ngày. Loại bỏ những phôi chết trước 24h.
+ Phôi chết xảy ra trong 4-10 ngày, có bệnh tích còi cọc, xuất huyết lan rộng.
- Đánh giá kết quả:
Tính toán chỉ số trung hoà NI (neutralization index).
b. Phương pháp trung hoà trên tế bào xơ phôi vịt (DEF):
- Chuẩn bị:
+ Tế bào DEF trên đĩa nuôi cấy tế bào 96 lỗ đã nuôi cấy được 2-3 ngày.
+ Pha loãng virus phân lập: các nồng độ 10-1–10-9 với môi trường nuôi cấy MEM.
+ Lô đối chứng (+): trộn kháng huyết thanh dương tính DTV với các nồng độ virus đã pha loãng theo tỷ lệ 1:1.
+ Lô đối chứng (-): trộn huyết thanh (-) tính với các nồng độ virus đã pha loãng theo tỷ lệ 1:1.
- Tiến hành:
+ Gây nhiễm hỗn hợp trên vào đĩa đã nuôi cấy tế bào DEF (đĩa 96 lỗ), 100µl/lỗ, 8 lỗ/nồng độ.
+ Ủ đĩa nuôi cấy ở tủ ấm CO2 ở 37oC/1h.
+ Đổ bỏ hỗn hợp trên, cho môi trường nuôi cấy MEM 100µl/lỗ.
+ Tiếp tục ủ đĩa nuôi cấy ở tủ ấm CO2 ở 37oC.
+ Kiểm tra bệnh lý tế bào (CPE) trong 3-7 ngày với biểu hiện tế bào to tròn và tụ lại thành từng đám, thời gian lâu có hiện tượng tế bào bi hoại tử.
- Đánh giá kết quả:
+ Tính toán chỉ số trung hoà NI (neutralization index).
5.3.1.3. Phát hiện virus Dịch tả vịt bằng phương pháp PCR:
PCR có thể dùng để phát hiện virus DTV trong các tổ chức như: Thực quản, gan và lách hoặc sau khi tiến hành phân lập trên phôi vịt.
a. Chiết tách DNA virus:
DNA có thể chiết tách từ dịch tế bào phân lập virus, huyễn dịch bệnh phẩm 10% hoặc dịch ngoáy ổ nhớp.
- Bước 1: Đối với huyễn dịch bệnh phẩm 10%: Nhỏ 400 µl vào ống 1.5ml và ly tâm ở 16000 g trong 5 phút. Hút dịch nổi sang ống mới và bắt đầu bước 2
- Bước 2: Đối với dịch tế bào và dịch ngoáy ổ nhớp: Nhỏ 400 µl mẫu hoặc dịch nổi từ bước trên vào ống 1.5 ml và ly tâm ở 16000 – 20000 g trong 45 phút để lắng virus
- Bước 3: Đổ bỏ dịch nổi và hòa tan cặn lắng bằng 200 µl dung dịch Tris/EDTA (10 mM Tris/HCl, pH 8.0, 1 mM EDTA)
- Bước 4: Thêm 10 µl dung dịch proteinase K 5 µg/µl để đạt nồng độ cuối là 0,2 µg/µl, trộn đều và ủ ở 56oC trong 1 giờ
- Bước 5: Thêm 25 µl dung dịch SDS 10% để nồng độ cuối là 1%, trộn đều và ủ ở 37oC trong 1 giờ.
- Bước 6: Thêm 15 µl NaCl 5M để đạt nồng độ cuối cùng là 0,3 M và trộn đều
- Bước 7: Thêm 300 µl dung dịch phenol đệm với Tris/HCl, pH 8,0 và trộn đều (có thể bằng cách đảo lộn ống 50 lần)
- Bước 8: Ly tâm ống ở 16000 g trong 5 phút và chuyển pha nước nổi sang ống mới
- Bước 9: Lặp lại bước 7 và 8 thêm lần nữa
- Bước 10: Thêm 500 µl ether trộn đều, và ly tâm ở 16000 g trong 1 phút
- Bước 11: Hút bỏ pha nước, và lặp lại bước 10 1 lần nước
- Bước 12: mở nắp ống và để ở nhiệt độ 56oC trong 15 phút hoặc đến khi ngửi thấy hết mùi ether
- Bước 13: Chia lượng mẫu trong ống làm 2, và thêm lượng cồn tuyệt đối gấp 2,25 lần lượng mẫu và trộn đều, để ở nhiệt độ phòng (22oC) trong 30 phút
- Bước 14: Ly tâm ở 16000 g trong 45 phút và bỏ nước nổi
- Bước 15:Thêm 200 µl cồn 70% hòa tan nhẹ nhàng cặn lắng và lại ly tâm ở 16000 g trong 15 phút
- Bước 16: Bỏ dịch nổi và làm khô cặn lắng ở 56oC trong 30-45 phút
- Bước 17: Hòa tan DNA bằng 30 µl nước cất RNAse vàDNAse free.
- Có thể để mẫu ở 4oC trong vài ngày hoặc ở -20oC nều muốn bảo quản lâu
b. Chạy PCR
Khi pha các hỗn hợp phản ứng nên theo hướng dẫn của nhà sản xuất đối với phản ứng hot start PCR
Trình tự cặp mồi (primer) dùng để phát hiện virus Dịch tả vịt
Primer 1 | 5'-GAA-GGC-GGG-TAT-GTA-ATG-TA-3' (tiến) |
Primer 2 | 5'-CAA-GGC-TCT-ATT-CGG-TAA-TG-3' (lùi) |
Chu trình nhân gien
1 vòng | 94°C - 2 phút |
| 37°C - 1 phút |
35 vòng | 94°C - 1 phút |
| 55°C - 1 phút |
| 72°C - 3 phút |
1 vòng | 72°C for 7 phút |
| Giữ ở 4oC đến khi chạy điện di |
Chạy điện di sản phẩm PCR
- Pha thạch Agar 1% bằng dung dịch đệm TAE, đun cho tan đều, khi đã nguội, đổ vào khuôn điện di (có lược)
- Khi thạch đã đông, để vào trong buồng điện di có đệm TAE
- Các sản phẩm PCR được pha với dung dịch loading với tỷ lệ 1/10 và nhỏ vào các giếng trên miếng thạch Agar (10 µl/mẫu)
- Chạy điện di trong 1 giờ ở nhiệt độ 120 v, sau đó nhuôm thạch với ethidium bromide trong 20 phút. Rửa bỏ thuốc nhuộm bằng cách ngâm trong nước cất 45 phút và đọc kết quả bằng ánh sáng UV, chụp ảnh.
c. Đọc kết quả:
- Mẫu đối chứng dương và các mẫu dương tính có vạch với kích cỡ 446 bp
- Mẫu đối chứng âm và các mẫu âm tính không có vạch.
5.3.2. Phát hiện kháng thể:
Sử dụng phương pháp trung hoà (SN – Serum Nertralization) để phát hiện kháng thể: Phương pháp này được thực hiện trên trứng vịt có phôi, hoặc trên tế bào DEF
Mẫu: là huyết thanh vịt nghi mắc bệnh.
5.3.2.1. Trên trứng vịt có phôi: 10-14 ngày tuổi.
- Chuẩn bị:
+ Xử lý mẫu huyết thanh ở 56oC /30p.
+ Pha loãng mẫu huyết thanh theo cơ số 2 ở 10 nồng độ (1/5, 1/10,...1/2560).
+ Pha loãng virus DTV liều 100 EID50.
- Tiến hành:
+ Trộn virus DTV và huyết thanh kiểm tra đã chuẩn bị ở trên theo tỷ lệ 1:1
+ Ủ hỗn hợp kháng nguyên – kháng thể ở tủ ấm 37oC/1h .
+ Tiêm hỗn hợp trên vào xoang niệu mô phôi trứng (0,2ml/phôi), 5 phôi/nồng độ.
+ Trứng được ấp tiếp ở 37oC trong 14 ngày.
+ Soi trứng. Loại bỏ những phôi chết trước 24h.
- Đánh giá kết quả:
+ Phôi chết xảy ra trong 4-10 ngày với bệnh tích còi cọc, xuất huyết lan rộng.
+ Tính toán chỉ số trung hoà NI và hiệu giá trung hoà theo công thức của Reed và Muench
5.3.2.2. Trên tế bào xơ phôi vịt DEF:
- Chuẩn bị:
+ Làm và pha loãng tế bào DEF với số lượng cần thiết (4x105 tế bào/ml).
+ Xử lý mẫu huyết thanh ở 56oC /30p.
+ Pha loãng virus DTV chuẩn liều 100 TCID50(50% Tissue culture infective dose).
- Tiến hành: Trên đĩa nuôi cấy 96 lỗ.
+ Cho môi trường nuôi cấy MEM: 50µl/lỗ vào các lỗ của đĩa.
+ Cho mẫu huyết thanh kiểm tra: 50µl vào lỗ đầu tiên, cột 1.
+ Pha loãng mẫu huyết thanh theo cơ số 2 (1/2, 1/4,...) từ cột 1-12.
+ Cho virus DTV chuẩn liều 100 TCID50 : 50µl/lỗ.
+ Ủ đĩa nuôi cấy ở tủ ấm CO2 ở 37oC/1h .
+ Đổ bỏ hỗn hợp trên, cho môi trường MEM (không bổ sung FCS) 100µl/lỗ.
+ Ủ tiếp đĩa nuôi cấy ở tủ ấm CO2 ở 37oC trong 5-7 ngày.
- Đánh giá kết quả:
+ Kiểm tra bệnh lý tế bào (CPE) trong 3-7 ngày. Tế bào có biểu hiện to tròn và tụ lại từng đám, thời gian lâu có hiện tượng tế bào bị hoại tử.
+ Tính toán chỉ số trung hoà NI và hiệu giá trung hoà theo công thức của Reed và Muench.
6. Kết luận:
- Nếu kết quả phân lập và giám định (bằng phương pháp trung hòa VN) dương tính với kháng huyết thanh chuẩn, kết luận có virus Dịch tả vịt.
- Nếu kết quả PCR dương tính, kết luận dương tính virus Dịch tả vịt.
- Nếu thủy cầm chưa tiêm phòng, phát hiện có kháng thể Dịch tả vịt (bằng phương pháp trung hòa SN), kết luận thuỷ cầm đã nhiễm virus Dịch tả vịt.
- Nếu kết quả phân lập âm tính, PCR âm tính, kết luận âm tính virus Dịch tả vịt.
7. Tài liệu tham khảo
1. Manual of standards for diagnosis tests and vaccines (OIE).
2. Manual of standards for diagnosis tests (Thailand).
PHỤ LỤC
1. Công thức pha môi trường:
• Dung dịch PBSx10:
Thành phần:
NaCl 80,0gr
KCl 2,0gr
Na2HPO4 11,5gr
KH2PO4 2,0gr
Pha loãng với 1000ml nước cất, điều chỉnh pH = 7,2.
Hấp tiệt trùng, bảo quản ở 4oC.
• 7% NaHCO3:
Thành phần:
NaHCO3 7gr
Nước cất 100ml
Hấp tiệt trùng và bảo quản ở 4oC.
• 3% L-glutamine:
Thành phần:
L-glutamine 3 gr
Nước cất 100ml
Lọc vô trùng, bảo quản ở -20oC. Pha loãng virus VGV chuẩn liều 100 TCID50.
• TPB – Tryptose Photphat Broth:
• Thành phần:
Tryptose Photphat 29,5gr
Nước cất 1000ml
Hấp tiệt trùng, bảo quản ở 4oC.
• Trypsine 2,5% (10x):
Thành phần:
Trypsine 2,5gr
PBS 100ml
Lắc qua đêm ở 4oC, lọc vô trùng và bảo quản ở -20oC.
• Môi trường nuôi cấy tế bào MEM:
Thành phần:
Eagle’s minimum essential medium (MEM) 430 ml
Tryptose Photphat Broth (TPB) 50 ml
3% L-glutamine 5 ml
7% NaHCO3 5 ml
Kháng sinh (Peni. + Strep.) 5 ml
Fetal calf serum (FCS) 5 ml
2. Phương pháp làm tế bào Xơ phôi vịt
Sử dụng phôi vịt 9 -10 ngày tuổi.
1 - Mổ trứng, lấy phôi vịt.
2 - Rửa phôi trong dung dịch PBS có chứa 1% kháng sinh.
3 - Cắt bỏ đầu, chân, cánh và các cơ quan phủ tạng, thu hoạch gan phôi.
4 - Rửa phôi 1-2 lần trong dung dịch PBS có chứa 1% kháng sinh.
5 - Cắt nhỏ phôi.
6 - Tách tế bào bằng dung dịch Trypsine ấm 0,25% và lắc nhẹ 250v/p trong 15 phút.
7 - Thu hoạch tế bào đã tách cho vào môi trường MEM + 10% huyết thanh FCS, bảo quản trong phích đá.
8 - Nhắc lại bước 6-7.
9 - Ly tâm huyễn dịch tế bào 1500v/p, ở 4oC trong 5 phút.
10 - Rửa 1 lần với môi trường nuôi cấy.
11 - Đếm và pha loãng tế bào với môi trường phát triển (MEM + 10% FCS), lượng tế bào cần thiết tối thiểu 4x105 tế bào/ml.

4. Công thức tính chỉ số trung hoà NI của Reed and Muench.
4.1. Phương pháp trung hoà virus (VN):
Dựa theo ví dụ sau:
Virus pha loãng (log10) | -1 | -2 | -3 | -4 | -5 | -6 | -7 | -8 | - log10 EID50 | NI |
Hthanh (-) |
|
|
|
| *5/5 | 4/5 | 1/5 | 0/5 | 6.5 |
|
Hthanh (+) | 5/5 | 5/5 | 0/5 |
|
|
|
|
| 2.5 | 4.0 |
*: số chết/số tiêm.
Chỉ số NI là sự chênh lệch giữa EID50 (hoặc LD50, TCID50)của lô đối chứng (+) và (-)
Chỉ số NI = 4.0
