Tiêu chuẩn Việt Nam TCVN 4829:2001 về Vi sinh vật học - Hướng dẫn chung về phương pháp phát hiện Salmonella do Bộ Khoa học Công nghệ và Môi trường ban hành đã được thay thế bởi Tiêu chuẩn Việt Nam TCVN 4829:2005 (ISO 6579 : 2002) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện Salmonella trên đĩa thạch do Bộ Khoa học và Công nghệ ban hành .
Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 4829:2001 về Vi sinh vật học - Hướng dẫn chung về phương pháp phát hiện Salmonella do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 4829 : 2001
VI SINH VẬT HỌC – HƯỚNG DẪN CHUNG VỀ PHƯƠNG PHÁP PHÁT HIỆN SALMONELLA
Microbiology - General guidance on methods for the detection of Salmonella
Cảnh báo - Để bảo vệ sức khoẻ cho nhân viên phòng thí nghiệm, các phép thử phát hiện Salmonella chỉ được tiến hành trong các phòng thí nghiệm được trang bị đầy đủ, dưới sự kiểm soát của cán bộ vi sinh vật có kỹ năng, và phải hết sức cẩn thận khi thải loại các vật liệu đã cấy mẫu.
1. Phạm vi áp dụng
Tiêu chuẩn này đưa ra hướng dẫn chung về phương pháp phát hiện Salmonella.
Giới hạn của phương pháp được trình bày trong phần giới thiệu. Tiêu chuẩn này áp dụng cho thực phẩm hoặc thức ăn chăn nuôi.
Nhiệt độ nuôi cấy (35oC hoặc 37°C) sẽ do các bên có liên quan thoả thuận và phải được qui định trong báo cáo thử nghiệm.
2. Tiêu chuẩn viện dẫn
TCVN 4881 : 1989 (ISO 6887: 1983), Vi sinh vật học - Hướng dẫn chung về cách pha chế các dung dịch pha loãng để kiểm nghiệm vi sinh vật.
TCVN 6404 : 1998 (ISO 7218: 1997), Vi sinh vật trong thực phẩm và trong thức ăn gia súc - Nguyên tắc chung về kiểm tra vi sinh vật.
3. Định nghĩa
Trong tiêu chuẩn này áp dụng các định nghĩa sau:
3.1. Salmonella (Salmonella): Vi sinh vật hình thành các khuẩn lạc điển hình trên môi trường đặc chọn lọc, có những đặc tính sinh hoá và huyết thanh học như được mô tả khi thử nghiệm được tiến hành theo tiêu chuẩn này.
3.2 Phát hiện Salmonella (detection of Salmonella): Xác định sự có mặt hay không của những vi sinh vật này trong một lượng mẫu cụ thể, khi phép thử được tiến hành phù hợp với tiêu chuẩn này.
4. Nguyên tắc
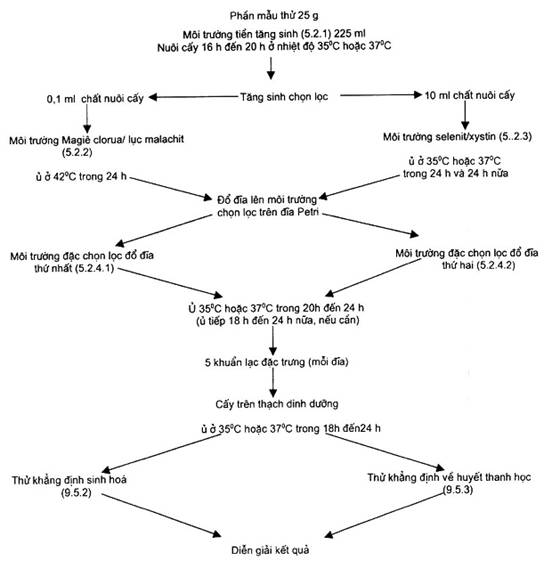
Việc phát hiện Salmonella phải qua bốn giai đoạn nối tiếp nhau (xem phụ lục A).
Chú thích 1 - Salmonella có thể hiện diện với số lượng nhỏ và thường kèm theo một lượng khá lớn các vi sinh vật thuộc họ Enterobacteriaceae hoặc họ khác. Vì vậy, việc tăng sinh chọn lọc là cần thiết; ngoài ra, quá trình tiền tăng sinh thường là cần thiết cho việc phát hiện Salmonella đã bị yếu hay bị suy giảm có trong mẫu thử.
4.1. Tiền tăng sinh trong môi trường lỏng không chọn lọc
Cấy phần mẫu thử vào nước pepton có đệm (cũng dùng để pha loãng) và nuôi ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận) trong 16 h - 20 h.
4.2. Tăng sinh trong môi trường lỏng chọn lọc
Cấy chất nuôi cấy thu được ở 4.1 vào môi trường magie clorua/lục malachit và môi trường selenit/ xystin.
Ủ môi trường magie clorua/ lục malachit ở 42oC trong 24 h và môi trường selenit/xystin ở 35oC hoặc 37oC (theo thoả thuận) trong 24 h và thêm 24 h nữa.
4.3. Cấy lên đĩa thạch và nhận dạng
Từ chất nuôi cấy thu được ở 4.2, cấy vào hai môi trường đặc chọn lọc sau:
- môi trường thạch đỏ phenol/lục sáng, ngoại trừ trường hợp có tiêu chuẩn cụ thể đối với sản phẩm cần thử, hoặc vì những mục đích khác (ví dụ: phân lập Salmonella đường lactoza dương tính) yêu cầu phải thay thế một môi trường nào đó làm môi trường bắt buộc.
- bất kì môi trường đặc chọn lọc nào khác (xem 5.2. 4.2).
Ủ ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận) và kiểm tra sau 24 h, và nếu cần, sau 48 h để kiểm tra sự có mặt của các khuẩn lạc có các đặc trưng được coi là Salmonella giả định.
4.4. Phép thử khẳng định
Cấy truyền các khuẩn lạc Salmonella giả định được nuôi trên đĩa như mô tả trong 4.3 và tiến hành thử khẳng định bằng các phép thử sinh hoá và huyết thanh học thích hợp.
5. Môi trường nuôi cấy, thuốc thử và huyết thanh
5.1. Khái quát
Về thực hành phòng thí nghiệm, xem TCVN 6404:1998 (ISO 7218).
5.2. Môi trường nuôi cấy và thuốc thử
Chú thích 2 - Do phương pháp có sử đụng nhiều loại môi trường nuôi cấy và thuốc thử, để thuận tiện khi sử dụng, thành phần và cách chuẩn bị chúng được nêu trong phụ lục B.
5.2.1. Môi trường tiền tăng sinh không chọn lọc: Nước pepton có đệm
Xem B.1.
5.2.2. Môi trường tăng sinh chọn lọc thứ nhất: Môi trường Magie clorua/ lục malachit Rapport - Vassiliadis (môi trường RV)
Xem B.2.
5.2.3. Môi trường tăng sinh chọn lọc thứ hai: Môi trường selenit/ xystin
Xem B.3.
5.2.4. Môi trường đặc chọn lọc đổ đĩa
5.2.4.1. Môi trường thứ nhất: Thạch đỏ phenol/ lục sáng (Edel và Kampelmacher)
Xem B.4.
Môi trường thứ nhất là bắt buộc trừ khi có quy định khác (xem 4.3).
5.2.4.2. Môi trường thứ hai
Việc lựa chọn môi trường thứ hai là tuỳ từng phòng thí nghiệm, trừ khi có tiêu chuẩn cụ thể liên quan đến sản phẩm cần kiểm tra, trong đó qui định thành phần của môi trường thứ hai này.
5.2.5. Thạch dinh dưỡng
Xem B.5.
5.2.6. Thạch 3 đường / sắt (thạch TSI)
Xem B.6.
5.2.7. Thạch Ure (Christensen)
Xem B. 7.
5.2.8. Môi trường L- Lysin decacboxyl
Xem B.8.
5.2.9. Thuốc thử phát hiện β-galactosidaza (hoặc dùng các đĩa giấy làm sẵn, sử dụng theo chỉ dẫn của nhà sản xuất)
Xem B.9.
5.2.10. Thuốc thử phản ứng Voges-Preskauer (phản ứng VP)
Xem B.10.
5.2.10.1. Môi trường VP
5.2.10.2. Dung dịch creatin (N-amidinosarcosin)
5.2.10.3. 1-Naphtol, pha trong dung dịch cồn etylic
5.2.10.4. Dung dịch kali hidroxít
5.2.11. Thuốc thử phản ứng Indol
Xem B.11.
5.2.11.1. Môi trường tryptophan - trypton
5.2.11.2. Thuốc thử Kovacs (hợp chất N,N - dixyclohexyl-cacbodimid pentachlorophenol)
5.2.12. Thạch dinh dưỡng bán đặc
Xem B.12.
5.2.13. Dung dịch muối
Xem B.13
5.3. Huyết thanh
Các hãng cung cấp hoá chất có bán sẵn một số loại huyết thanh ngưng kết có chứa kháng thể đối với một hoặc một vài kháng nguyên O. Nghĩa là chỉ kháng thể có chứa một hoặc nhiều nhóm "O" (được gọi là kháng huyết thanh "O" đơn giá hoặc đa giá) kháng huyết thanh Vi, và kháng huyết thanh chứa kháng thể đối với một hoặc một số yếu tố H còn gọi là kháng huyết thanh - H đơn giá hay đa giá).
Cần thử trước các kháng huyết thanh để đảm bảo là chúng thích hợp cho việc phát hiện tất cả các serotype Salmonella. Vấn đề này có thể được trợ giúp bằng cách sử dụng kháng huyết thanh của một nhà cung cấp đã được công nhận (ví dụ, họ được một tổ chức thích hợp của chính phủ công nhận).
6. Thiết bị và dụng cụ thuỷ tinh
Chú thích 3 - Có thể sử dụng thiết bị, dụng cụ dùng một lần thay cho việc sử dụng lại các dụng cụ thuỷ tinh nếu chúng đáp ứng được yêu cầu quy định.
Các thiết bị thông thường của phòng thí nghiệm vi sinh, và đặc biệt là
6.1. Thiết bị để thanh trùng khô (tủ sấy) hoặc để thanh trùng ướt (nối hấp áp lực)
Xem TCVN 6404 : 1998 (ISO 7218).
6.2. Buồng sấy hoặc tủ sấy, được thông gió bằng cách đối lưu và có thể duy trì nhiệt độ 37oC ± 1oC và 55oC ± 1oC.
6.3. Tủ ấm, có thể hoạt động ở 35oC ± 1oC hoặc 37oC ± 1 oC tuỳ thuộc nhiệt độ thoả thuận.
6.4. Nồi cách thuỷ, có thể hoạt động ở 42,0 oC ± 1 oC hoặc tủ ấm có thể hoạt động ở 42,0 oC ± 0,5 oC.
6.5. Nồi cách thuỷ, có thể hoạt động ở 45 oC ± 1 oC, 55 ± 1 oC và 70 oC ± 1 oC.
6.6. Nồi cách thuỷ, có thể hoạt động ở 35 oC ± 1 oC hoặc 37 oC ± 1 oC, tuỳ thuộc nhiệt độ thoả thuận.
6.7. Vòng que cấy, bằng platin/iridi hoặc crom/niken, đường kính khoảng 3 mm.
6.8. pH met, có độ chính xác ± 0,1 đơn vị pH ở 25 oC.
6.9. Chai hoặc bình để nuôi cấy
Chú thích 4 - Có thể sử dụng chai hoặc bình có nút xoáy bằng chất dẻo hoặc kim loại không có độc tố.
6.10. Ống nuôi cấy, có đường kính 8 mm, dài 160 mm.
6.11. Ống đong
6.12. Pipet chia độ, có dung tích danh định 10 ml và 1 ml, có các vạch chia tương ứng 0,5 ml và 0,1 ml.
6.13. Đĩa Petri, loại đường kính nhỏ (đường kính 90 mm đến 100 mm) và/ hoặc loại lớn (đường kính 140 mm).
7. Lấy mẫu
Mẫu gửi đến phòng thí nghiệm phải là mẫu đại diện, trung thực không bị hư hỏng hay biến đổi trong quá trình bảo quản hoặc vận chuyển.
Phương pháp lấy mẫu không qui định trong tiêu chuẩn này. Xem tiêu chuẩn cụ thể đối với sản phẩm có liên quan. Nếu chưa có các tiêu chuẩn cụ thể thì các bên liên quan nên thoả thuận với nhau về vấn đề này.
8. Chuẩn bị mẫu thử
Cần chuẩn bị mẫu thử theo các tiêu chuẩn cụ thể cho mỗi sản phẩm. Nếu chưa có các tiêu chuẩn cụ thể thì các bên liên quan nên thoả thuận với nhau về vấn đề này.
9. Cách tiến hành
(Xem biểu đồ ở phụ lục A.)
9.1. Phần mẫu thử và huyền phù ban đầu
9.1.1 Xem TCVN 4881 : 1989 (ISO 6887) và tiêu chuẩn cụ thể liên quan đến sản phẩm.
Để chuẩn bị huyền phù ban đầu, dùng môi trường tiền tăng sinh ở 5.2.1 làm chất lỏng pha loãng.
9.1.2. Nói chung, để chuẩn bị huyền phù ban đầu, thêm 25 g phần mẫu thử vào 225 ml môi trường tiền tăng sinh (5.2.1), đây là tỉ lệ giữa phần mẫu thử và môi trường tiền tăng sinh qui định trong phương pháp này.
Nếu phần mẫu thử qui định khác 25 g thì dùng lượng môi trường tiền tăng sinh cần thiết để có được một dung dịch pha loãng xấp xỉ 1/10 (khối lượng theo thể tích).
Chú thích
5) Để giảm nhẹ công việc xét nghiệm, khi có nhiều phần mẫu thử 25 g từ một lô thực phẩm nhất định phải kiểm tra và khi có bằng chứng cho thấy việc phối trộn không ảnh hưởng đến kết quả đối với sản phẩm cụ thể đó thì có thể gộp các phần mẫu đó lại. Thí dụ, nếu cần phải xét nghiệm 10 phần mẫu 25 g thì gộp chúng lại để tạo thành một lượng mẫu 250 g và đưa vào 2,25 lít canh thang tiền tăng sinh. Hoặc cách khác, có thể phối hợp 0,1 ml (môi trường RV) và 10 ml phần mẫu thử canh thang tiền tăng sinh (môi trường selenit/xystin) từ 10 phần mẫu thử riêng rẽ (9.3.1) trong 0,1 lít và 1 lít môi trường tăng sinh chọn lọc tương ứng.
6) Các thực phẩm dạng khô hoặc dạng bột có thể cần một quy trình hoá lỏng đặc biệt để làm tăng khả năng phục hồi Salmoneila trong mẫu. Hai kỹ thuật có thể sử dụng cho mục đích này đó là ngâm và trộn, về điều này nên tham khảo các tiêu chuẩn liên quan đến sản phẩm đang xét nghiệm. Nếu các tiêu chuẩn như vậy không có sẵn thì các bên có liên quan nên thoả thuận với nhau về vấn đề này.
9.2. Tiền tăng sinh không chọn lọc
Nuôi huyền phù ban đầu ở 35oC hoặc 37oC (theo thoả thuận) ít nhất 16 h và tối đa là 20 h.
9.3. Tăng sinh chọn lọc
9.3.1. Cấy chuyển 0,1 ml chất nuôi cấy thu được ở 9.2 sang một ống nghiệm có chứa 10 ml môi trường RV (5.2.2). Cấy chuyển 10 ml chất nuôi cấy thu được ở 9.2 sang bình có chứa 100 ml môi trường selenit/xystin (5.2.3).
9.3.2. Nuôi 2 môi trường đã cấy ở (9.3.1) trong 18 h đến 24 h như sau:
a) môi trường RV đã cấy nuôi ở 42oC trong 24 h;
b) môi trường đã cấy có selenit/xystin nuôi ở 35oC hoặc 37oC (theo thoả thuận) 24 h và tiếp theo 24 h nữa.
Chú thích 7 - Đối với môi trường selenit/xystin, trong một số trường hợp có thể tăng nhiệt độ đến 42oC để tăng hiệu quả. Điều này cần chỉ ra trong báo cáo thử nghiệm.
9.4. Cấy lên đĩa và nhận dạng
9.4.1. Dùng chất nuôi cấy thu được trong môi trường RV sau 24 h nuôi, sử dụng vòng que cấy (6.7) cấy lên bề mặt của đĩa Petri lớn (6.13) có chứa môi trường chọn lọc đổ đĩa thứ nhất (phần lớn là thạch đỏ phenol/lục sáng xem 5.2.4.1) sao cho sẽ thu được những khuẩn lạc tách biệt rõ ràng.
Nếu không có đĩa Petri lớn thì dùng hai đĩa Petri nhỏ, chỉ dùng một vòng cấy cấy liên tiếp lên hai dĩa (xem chú thích 8).
Tiến hành tương tự đối với môi trường chọn lọc đổ đĩa thứ hai (5.2.4.2), sử dụng que cấy mới và các đĩa Petri có kích thước thích hợp..
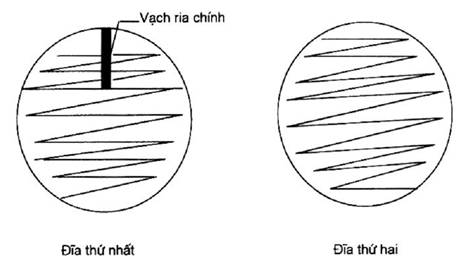
Chú thích 8 - Dùng phương pháp ria cấy sau đây cho môi trường thạch đỏ phenol/lục sáng. Lấy một vòng que cấy (6.7) dùng cho cả hai đĩa. Lấy một giọt nhỏ ở mép trên lớp bề mặt của dung dịch. Ria cấy lên cả hai đĩa theo biểu đồ ở phụ lục D. Cấy lên bề mặt đĩa với các đường cấy cách nhau 0,5 cm (không được đốt lửa que cấy hoặc lấy một vòng canh khuẩn khác, sau khi cấy xong vòng thứ nhất cũng như khi chuyển sang đĩa thứ hai). Khi chỉ dùng một đĩa lớn thì phương pháp ria cấy cũng giống như đã mô tả cho đĩa thứ nhất trong phụ lục D.
9.4.2. Dùng chất nuôi cấy trong môi trường selenit/xystin sau khi ủ ấm 24 h, lặp lại thao tác như đã mô tả ở 9.4.1, với hai môi trường đổ đĩa chọn lọc.
9.4.3. Lật ngược các đĩa Petri (9.4.1) và (9.4.2) cho đáy quay lên trên, đặt vào tủ ấm (6.3) ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận).
9.4.4. Sau khi nuôi môi trường selenit/xystin 48 h (xem 9.3.2 và 9.4.3), lặp lại qui trình mô tả trong 9.4.2 và 9.4.3
9.4.5. Sau khi nuôi các đĩa 20 h - 24 h, kiểm tra sự hình thành các khuẩn lạc Salmonella điển hình ở các đĩa (9.4.3 và 9.4.4). Các khuẩn lạc Salmonella điển hình mọc trên môi trường thạch đỏ phenol/lục sáng sẽ làm màu môi trường biến đổi từ màu hồng đến màu đỏ.
9.4.6. Nếu Salmonella mọc yếu hoặc không có khuẩn lạc điển hình thì phải nuôi tiếp ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận) trong 18 h - 24 h nữa.
Kiểm tra lại xem có xuất hiện khuẩn lạc salmonnella điển hình trên các đĩa thạch.
Chú thích 9 - Bất kỳ một khuẩn lạc điển hình hay nghi ngờ nào cũng cần được khẳng định (9.5). Việc nhận biết khuẩn lạc Salmonella cần phải có kinh nghiệm, hình thái của khuẩn lạc rất khác nhau không phải chỉ ở giữa các chủng mà còn rất khác nhau giữa các đợt nuôi cấy, ở giai đoạn này việc tiến hành phản ứng ngưng kết với kháng huyết thanh Salmonella đa giá sẽ tạo điều kiện thuận lợi cho việc nhận biết các khuẩn lạc nghi ngờ.
9.4.7. Có thể sử dụng bộ phép thử nhận biết Salmonella thương phẩm để nhận dạng Salmonella.
9.5. Phép thử khẳng định
9.5.1. Chọn các khuẩn lạc để thử khẳng định
Từ mỗi đĩa môi trường chọn lọc (9.4.5 và 9.4.6) lấy ra 5 khuẩn lạc được coi là điển hình hoặc nghi ngờ để thử khẳng định.
Nếu trên một đĩa có ít hơn 5 khuẩn lạc điển hình hoặc nghi ngờ thì lấy tất cả khuẩn lạc điển hình hoặc nghi ngờ đó để thử khẳng định.
Ria cấy những khuẩn lạc đã chọn lên bề mặt thạch dinh dưỡng đổ đĩa đã sấy khô trước (5.2.5) sao cho các khuẩn lạc sẽ được tách biệt rõ ràng. Nuôi các đĩa đã cấy ở 35oC hoặc 37oC (theo thoả thuận) trong 18 h - 24 h.
Dùng chất nuôi cấy thuần khiết để khẳng định về sinh hoá và huyết thanh.
9.5.2. Thử khẳng định sinh hoá
Dùng que cấy, cấy từng khuẩn lạc thu được từ các khuẩn chọn lọc trong 9.5.1 vào các môi trường qui định trong 9.5.2.1 đến 9.5.2.6
9.5.2.1. Thạch TSI (5.2.6)
Ria cấy trên bề mặt nghiêng và cấy sâu xuống đáy.
Nuôi cấy ở 35oC hoặc 37oC (theo thoả thuận) trong 24 h.
Diễn giải những thay đổi trong môi trường như sau:
Phần đáy ống
Màu vàng: glucoza dương tính (lên men glucoza)
Màu đỏ hoặc không đổi màu: glucoza âm tính (không lên men glucoza)
Màu đen: hình thành hydro sunfua
Bọt hoặc vết nứt: sinh khí từ glucoza
Mặt nghiêng
Màu vàng: lactoza và/hoặc sucroza dương tính (sử dụng lactoza và/hoặc sucroza)
Đỏ hoặc khổng đổi: lactoza và sucroza âm tính (không sử dụng lactoza hoặc sucroza)
Các chủng Salmonella điển hình thể hiện mặt thạch nghiêng kiềm tính (màu đỏ), có sinh khí và axit (màu vàng) ở đáy, tạo thành hydro sunfua (thạch bị đen) (khoảng 90% trường hợp).
Khi có chủng Salmonella lactoza dương tính được phân lập (xem 4.3) thì mặt thạch nghiêng có màu vàng. Do đó, việc khẳng định sơ bộ không chỉ dựa vào kết quả trên thạch TSI (xem 9.5.3).
9.5.2.2. Thạch ure (5.2.7)
Ria trên mặt thạch nghiêng.
Nuôi ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận) trong 24 h và kiểm tra thường xuyên.
Nếu phản ứng dương tính thì ure bị phân giải và giải phóng amoni làm chuyển màu đỏ phenol thành màu hoa hồng và sau đó chuyển sang màu đỏ hồng thẫm. Phản ứng thường xuất hiện sau 2 h đến 4 h.
9.5.2.3. Môi trường L-Lysin decacboxyl (5.2.8)
Cấy ngay phía dưới bề mặt của môi trường lỏng.
Nuôi trong 24 h ở 35oC hoặc 37oC (theo thoả thuận).
Xuất hiện màu đỏ tía hay màu tím sau khi nuôi cấy chứng tỏ phản ứng dương tính.
Màu vàng sau khi nuôi cấy chứng tỏ phản ứng âm tính.
9.5.2.4. Thuốc thử để phát hiện β-galactosidaza (5.2.9)
Hoà một vòng que cấy từ khuẩn lạc nghi ngờ vào ống nghiệm có chứa 0,25 ml dung dịch muối (5.2.13).
Thêm 1 giọt toluen và lắc đều.
Để ống nghiệm vào nồi cách thuỷ (6.6) ở 35oC hoặc 37oC (theo thoả thuận) trong vài phút.
Cho thêm 0,25 ml thuốc thử phát hiện β-galactosidaza và trộn đều.
Đặt lại ống nghiệm vào nồi cách thuỷ 35oC hoặc 37oC trong 24 h (theo thoả thuận), kiểm tra thường xuyên.
Phản ứng dương tính cho màu vàng, thường xuất hiện sau 20 phút.
Nếu sử dụng đĩa giấy bán sẵn (5.2.9), cần theo hướng dẫn của nhà sản xuất.
9.5.2.5. Môi trường thử phản ứng Voges - Proskauer (VP) (5.2.10)
Hoà một vòng que cấy khuẩn lạc nghi ngờ vào ống nghiệm thanh trùng có chứa 0,2 ml môi trường VP (5.2.10.1).
Nuôi ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận) trong 24 h.
Sau khi ủ, thêm vào hai giọt dung dịch creatin (5.2.10.2), ba giọt 1-naphtol pha trong dung dịch cồn etanol (5.2.10.3) và sau đó là hai giọt dung dịch kali hydroxit (5.2.10.4); lắc đều sau khi cho thêm từng loại thuốc thử.
Phản ứng dương tính là khi có xuất hiện màu hồng đến màu đỏ tươi trong vòng 15 phút.
9.5.2.6. Môi trường thử phản ứng Indol (5.2.11)
Cấy từ khuẩn lạc nghi ngờ vào một ống nghiệm có 5 ml môi trường trypton-tryptophan (5.2.11.1).
Nuôi ở nhiệt độ 35oC hoặc 37oC (theo thoả thuận) trong 24 h.
Sau đó, thêm vào 1 ml thuốc thử Kovacs (5.2.11.2).
Phản ứng dương tính sẽ có một vòng màu đỏ trên lớp bề mặt ống thử.
Phản ứng âm tính vòng màu nâu vàng.
9.5.2.7. Diễn giải các phản ứng sinh hoá
Nói chung Salmonella cho những phản ứng sinh hoá như trong bảng 1.
Bảng 1
Phép thử1) | Phản ứng dương tính hay âm tính | Tỉ lệ phần trăm các chủng Salmonella có phản ứng2) |
TSI glucoza (hình thành axit) (9.5.2.1) | + | 100 |
TSI glucoza (sinh khí) (9.5.2.1) | + | 91,93) |
TSI lactoza (9.5.2.1) | - | 99,24) |
TSI sucrosa (9.5.2.1) | _ | 99.5 |
TSI hydro sunfua (9.5.2.1) | + | 91,6 |
Phân qiải ure (9.5.2.2) | - | 99 |
Lysin decacboxyl (9.5.2.3) | + | 94,65) |
Phản ứng β-galactosidaza (9.5.2.4) | _ | 98,54) |
Phản ứng Voges-Proskauer (9.5.2.5) | - | 100 |
Phản ứng Indol (9.5.2.6) | - | 98,9 |
1) W.H.Ewing và M.M. Ball., Các phản ứng sinh hóa của các chủng thuộc Salmonella. Trung tâm bệnh lây quốc gia, Atlanta, Georgia. Mỹ (1966). 2) Các tỷ lệ phần trăm này nói rằng không phải tất cả các chủng Salmonella có các phản ứng ghi "+' hoặc “-” .Các tỉ lệ phần trăm này có thể thay đổi tuỳ theo từng quốc gia hay từng loại thực phẩm. 3) Salmonellatyphi là yếm khí. 4) Subgenus III Salmonella (arizona) cho các phản ứng lactoza dương tính hoặc âm tính nhưng β-galactosidaza luôn dương tính, Subgenus II Salmonella cho phản ứng lactoza âm tính nhưng có thể cho phản ứng β-galactosidaza dương tính. Để nghiên cứu các chủng, cần tiến hành các thử nghiệm sinh hoá bổ sung. 5) S.paratyphi là âm tính | ||
9.5.3. Khẳng định về huyết thanh học
Phát hiện sự có mặt của Salmonella có kháng nguyên O, Vi và H bằng phản ứng ngưng kết trên phiến kính với huyết thanh tương ứng từ các khuẩn lạc thuần khiết (9.5.1) và sau khi đã loại trừ những chủng tự ngưng kết.
9.5.3.1. Loại bỏ những chủng tự ngưng kết
Cho một giọt dung dịch muối (5.2.13) lên một phiến kính đã được làm sạch cẩn thận.
Trộn đều với khuẩn lạc cần kiểm tra thành một huyền phù đục và đều.
Lắc nhẹ trong 30 giây - 60 giây.
Xem xét kết quả trên nền tối, tốt nhất là với kính lúp.
Nếu các vi khuẩn dính kết thành các đơn vị ít hoặc nhiều rõ rệt thì chủng này được coi là tự ngưng kết và không phải thử nghiệm tiếp vì không thể phát hiện kháng nguyên được.
9.5.3.2. Kiểm tra kháng nguyên O
Sử dụng một khuẩn lạc thuần khiết đã được xác định là không có khả năng tự ngưng kết, tiến hành theo 9.5.3.1, dùng một giọt kháng huyết thanh O (5.3) thay cho dung dịch muối.
Phản ứng được coi là dương tính, nếu có ngưng kết.
Lần lượt sử dụng các huyết thanh đa giá và đơn giá.
9.5.3.3. Kiểm tra kháng nguyên Vi
Tiến hành theo 9.5.3.1, nhưng thay dung dịch muối bằng một giọt kháng huyết thanh Vi (5.3).
Nếu có ngưng kết, phản ứng được coi là dương tính.
9.5.3.4. Kiểm tra kháng nguyên H
Cấy khuẩn lạc thuần khiết, không có khả năng tự ngưng kết vào môi trường thạch dinh dưỡng bán đặc (5.2.12).
Ủ môi trường ở 35oC hoặc 37oC (theo thoả thuận) trong 18 h - 24 h.
Dùng chất nuôi cấy này để kiểm tra kháng nguyên H theo (9.5.3.1) nhưng dùng một giọt kháng nguyên H (5.3) thay cho dung dịch muối.
Nếu có ngưng kết, phản ứng được coi là dương tính.
9.5.4. Diễn giải kết quả của các phản ứng sinh hoá và huyết thanh học
Bảng 2 cho phép diễn giải kết quả những phép thử khẳng định (9.5.2 và 9.5.3) tiến hành trên những khuẩn lạc đã chọn (9.5.1).
Bảng 2
Phản ứng sinh hoá | Tựngưng kết | Phản ứng huyết thanh | Diễn giải |
Điển hình | Không | Kháng nguyên O, Vi hoặc H dương tính | Các chủng được coi là Salmonella |
Điển hình | Không | Tất cả phản ứng âm tính | Có thể là Salmonella |
Điển hình | Có | Không thử (xem 9.5.3.1) | |
Không có phản ứng điển hình nào | Không | Kháng nguyênO, Vi hoặc H dương tính | |
Không có phản ứng điển hình nào | Không | Tất cả phản ứng âm tính | Không được coi là Salmonella |
9.5.5. Xác nhận định danh
Gửi những chủng được coi là Salmonella hoặc có thể là Salmonella (xem bảng 2) đến một trung tâm chuẩn được công nhận về Salmonella để xác định type.
Cần gửi theo tất cả thông tin liên quan đến các chủng đó.
10. Biểu thị kết quả
Căn cứ vào phần diễn giải kết quả, xác định có hay không có Salmonella trong phần mẫu thử x g của sản phẩm.
11. Báo cáo thử nghiệm
Bảo cáo thử nghiệm phải nêu rõ phương pháp sử dụng và kết quả thu được. Báo cáo thử nghiệm cũng phải nêu tất cả những điều kiện tiến hành mà tiêu chuẩn không qui định hoặc những điều được coi như tuỳ ý , cũng như các sự cố có thể ảnh hưởng tới kết quả.
Đặc biệt, phải báo cáo rõ về nhiệt độ nuôi cấy đã sử dụng, tức là 35oC hay 37oC và đối với môi trường selenit/ xystin thì liệu đã có đưa nhiệt độ nuôi cấy lên đến 42oC hay không.
Báo cáo thử nghiệm cũng cần nêu rõ xem có thu được kết quả dương tính không, khi chỉ sử dụng một môi trường đổ đĩa (5.2.4) không qui định trong tiêu chuẩn này.
Trong báo cáo phải bao gồm mọi thông tin cần thiết để nhận biết đầy đủ về mẫu.
12. Đảm bảo chất lượng
Để kiểm tra phòng thí nghiệm về khả năng phát hiện Salmonella theo tiêu chuẩn này. Cần đưa các mẫu chuẩn vào các bình đối chứng từ môi trường tiền tăng sinh (xem 5.2.1). Tiến hành với bình đối chứng như đối với môi trường nuôi để thử nghiệm.
Phụ lục A
(Qui định)
Sơ đồ qui trình
Phụ lục B
(Qui định)
Thành phần và cách chuẩn bị môi trường nuôi cấy và các thuốc thử
B.1 Nước pepton có đệm
B.1.1 Thành phần
Pepton | 10,0 g |
Natri clorua | 5,0 g |
Natri hydro phosphat ngậm 12 nước (Na2HPO4.12H2O) | 9,0 g |
Kali dihydro phosphat (KH2PO4) | 1,5 g |
Nước | 1 000 ml |
B.1.2 Chuẩn bị
Hoà tan các thành phần trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH để sau khi thanh trùng pH bằng 7,0, nếu cần.
Phân phối môi trường vào các bình có dung tích thích hợp để thu được phần mẫu thử cần thiết cho phép thử.
Thanh trùng bằng nồi hấp áp lực (6.1) ở nhiệt độ 121oC trong 20 phút.
B.2 Môi trường magie clorua - lục malachit Rappaport - Vassiliadis
B.2.1 Dung dịch A
B.2.1.1 Thành phần
Trypton | 5,0 g |
Natri clorrua | 8,0 g |
Kali dihydro phosphat (KH2PO4) | 1,6 g |
Nước | 1 000 ml |
B.2.1.2. Chuẩn bị
Hoà tan các thành phần trong nước bằng cách đun nóng đến khoảng 70oC.
Dung dịch này và môi trường RV cần được chuẩn bị cùng ngày.
B.2.2 Dung dịch B
B.2.2.1 Thành phần
Magie clorua ngậm 6 nước (MgCl2.6H2O) | 400,0 g |
Nước | 1 000 ml |
B.2.2.2 Chuẩn bị
Hoà tan magie clorua trong nước.
Do muối này hút ẩm mạnh, nên hoà tan MgCI2.6H2O từ bao bì mới mở theo tỷ lệ, thí dụ 250 g MgCI2.6H2O thì thêm 625 ml nước để có dung dịch với tổng thể tích 795 ml và nồng độ khoảng 31,5 g phần trăm MgCI2.6H2O.
Dung dịch có thể bảo quản trong chai thuỷ tinh màu nâu ở nhiệt độ phòng.
B.2.3 Dung dịch C
B.2.3.1 Thành phần
Oxalat lục malachit | 0,4 g |
Nước | 100 ml |
B.2.3.2 Chuẩn bị
Hoà tan oxalat lục malachit trong nước.
Dung dịch có thể bảo quản trong chai thuỷ tinh màu nâu ở nhiệt độ phòng.
B.2.4 Môi trường hoàn chỉnh
B.2.4.1 Thành phần
Dung dịch A (B.2.1) | 1 000 ml |
Dung dịch B (B.2.2) | 100 ml |
Dung dịch C (B.2.3) | 10 ml |
B.2.4.2 Chuẩn bị
Thêm 100 ml dung dịch B và 10 ml dung dịch C vào 1000 ml dung dịch A.
Chỉnh pH sao cho sau khi thanh trùng pH bằng 5,2, nếu cần.
Cho từng lượng 10 ml vào ống thử trước khi sử dụng.
Thanh trùng trong nồi hấp áp lực (6.1) ở 115oC trong 15 phút.
Bảo quản môi trường trong tủ lạnh.
B.3 Môi trường selenit/xystin
B.3.1 Môi trường cơ bản
B.3.1.1 Thành phần
Trypton | 5,0 g |
Lactoza | 4,0 g |
Dinatri hydro phosphat (Na2HPO4.12H2O) | 10, 0g |
Natri hydro selenit | 4,0 g |
Nước | 1 000 ml |
B.3.1.2 Chuẩn bị
Hoà tan ba thành phần cơ bản đầu tiên trong nước bằng cách đun sôi trong 5 phút. Sau khi làm nguội, cho thêm natri hydro selenit.
Chỉnh pH đến 7,0, nếu cần .
B.3.2 Dung dịch L-Xystin
B .3.2.1 Thành phần
L-Xystin | 0,1 g |
Dung dịch natri hydroxit, c(NaOH) = 1 mol/l | 15 ml |
Nước vô trùng, vừa đủ để có thể tích cuối cùng | 100 ml |
B.3.2.2 Chuẩn bị
Cho các thành phần trên vào bình định mức vô trùng
Pha loãng với nước vô trùng đến 100 ml
Không thanh trùng.
B.3.3 Môi trường hoàn chỉnh
B.3.3.1 Thành phần
Môi trường cơ bản (B.3.1) | 1 000 ml |
Dung dịch L-Xystin (B.3.2) | 10 ml |
B.3.3.2. Chuẩn bị
Làm nguội môi trường cơ bản và cho thêm dung dịch L-xystin một cách vô trùng.
Chỉnh pH đến 7,0, nếu cần.
Phân phối môi trường một cách thanh trùng vào các bình vô trùng có dung tích thích hợp để nhận được những phần mẫu cần thiết cho thử nghiệm.
Dùng môi trường trong ngày chuẩn bị.
B.4 Thạch đỏ phenol/lục sáng (Edel và Kampelacher)
B.4.1 Môi trường cơ bản
B.4.1.1 Thành phần
Bột cao men | 5,0 g |
Pepton | 10,0 g |
Bột cao nấm | 3,0 g |
Dinatri hidro phosphat (NaH2PO4) | 1,0 g |
Natri dihidro phosphat (NaH2PO4) | 0,6g |
Thạch bột hoặc thạch vẩy | 12 g đến 18 g1) |
Nước | 900 ml |
1) Phụ thuộc vào độ đông của thạch. | |
B.4.1.2 Chuẩn bị
Hoà tan các thành phần hoặc môi trường cơ bản hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH sao cho pH là 7,0 sau khi thanh trùng, nếu cần.
Chuyển dung dịch cơ bản vào các bình hoặc ống nghiệm có dung tích thích hợp.
Thanh trùng trong nồi hấp áp lực (6.2) ở 121oC trong 15 phút.
B.4.2 Dung dịch đỏ phenol/đường
B.4.2.1 Thành phần
Lactoza | 10,0 g |
Saccaroza | 10,0 g |
Đỏ phenol | 0,09 g |
Nước, đủ để có thể tích cuối cùng | 100 ml |
B.4.2.2 Chuẩn bị
Hoà tan các thành phần trong bình định mức với khoảng 50 ml nước.
Định mức bằng nước đến 100 ml.
Đặt trong nồi cách thuỷ ở 70oC trong 20 phút.
Để nguội đến 55oC ± 1oC và dùng ngay.
B.4.3 Dung dịch lục sáng
B.4.3.1 Thành phần
Lục sáng (xem quy định trong phần phụ lục C) | khoảng 0,5 g |
Nước | 100 ml |
B.4.3.2 Chuẩn bị
Cho lục sáng vào nước.
Bảo quản dung dịch ở chỗ tối ít nhất một ngày để quá trình tự thanh trùng diễn biến.
B.4.4 Môi trường hoàn chỉnh
B.4.4.1 Thành phần
Môi trường cơ bản (B.4.1) | 900 ml |
Dung dịch đỏ phenol/đường (B.4.2) | 100 ml |
Dung dịch lục sáng (B.4.3) | 1 ml |
B.4.4.2 Chuẩn bị
Trong điều kiện vô trùng cho dung dịch lục sáng vào dung dịch đỏ phenol/đường đã được làm nguội đến 55oC ± 1oC.
Cho tất cả vào môi trường cơ bản ở 50oC đến 55oC và trộn đều.
B.4.5 Chuẩn bị các đĩa thạch
Chuẩn bị một số đĩa phù hợp cho sử dụng cho vào mỗi đĩa Petri lớn (6.13) khoảng 40 ml môi trường hoàn chỉnh vừa chuẩn bị (B.4.4). (Nếu không có đĩa Petri lớn thì cho khoảng 15 ml môi trường vào một đĩa Petri nhỏ). Để cho đông đặc.
Ngay trước khi dùng, sấy đĩa thạch một cách cẩn thận (tốt nhất là mở nắp và úp mặt thạch xuống dưới) trong tủ sấy (6.2) ở 37oC đến 55oC cho đến khi mặt thạch khô.
Nếu chuẩn bị trước, khi dùng thì các đĩa thạch chưa khô không được giữ quá 4 h ở nhiệt độ phòng hoặc không quá một ngày trong tủ lạnh.
B.5 Thạch dinh dưỡng
B.5.1 Thành phần
Cao thịt | 3,0 g |
Pepton | 5,0 g |
Thạch | 12 g đến 18 g1) |
Nước | 1 000 ml |
1) Phụ thuộc sức đông của thạch. | |
B.5.2 Chuẩn bị
Hoà tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH sao cho pH là 7,0 sau khi thanh trùng, nếu cần.
Chuyển môi trường nuôi cấy vào ống nghiệm hoặc bình có dung tích thích hợp.
Thanh trùng trong nồi hấp áp lực (6.1) ở 121oC trong 20 phút.
B.5.3 Chuẩn bị các đĩa thạch dinh dưỡng
Chuyển 15 ml môi trường đã nóng chảy vào đĩa Petri nhỏ vô trùng (6.13) và tiến hành như B.4.5.
B.6 Thạch 3 đường / sắt (thạch TSI)
B.6.1 Thành phần
Cao thịt | 3,0 g |
Cao men | 3,0 g |
Pepton | 20,0 g |
Natri clorua | 5,0 g |
Lactoza | 10,0 g |
Saccaroza | 10,0 g |
Glucoza | 1,0 g |
Sắt III citrat | 0,3 g |
Natri thiosunfat | 0,3 g |
Đỏ phenol | 0,024 g |
Thạch | 12 g đến 18 g1) |
Nước | 1 000 ml |
1) Phụ thuộc vào sức đông của thạch | |
B.6.2 Chuẩn bị
Hoà tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần. Chỉnh pH đến 7,4 sau khi thanh trùng, nếu cần.
Chuyển từng lượng môi trường 10 ml vào các ống nghiệm.
Thanh trùng trong nồi hấp áp lực (6.1) ở 121oC trong 10 phút.
Đặt nghiêng ống nghiệm để đáy ống nghiêm sâu khoảng 2,5 cm.
B.7 Thạch urê (Christensen)
B.7.1 Môi trường cơ bản
B.7.1.1 Thành phần
Pepton | 1,0 g |
Glucoza | 1,0 g |
Natri Clorua | 5,0 g |
Kali dihydro phosphat (KH2PO4) | 2,0 g |
Đỏ phenol | 0,012 g |
Thạch | 12 đến 18 g1) |
Nước | 1 000 ml |
1) Phụ thuộc vào sức đông của thạch | |
B.7.1.2 Chuẩn bị
Hoà tan các thành phần hoặc môi trường hoàn chỉnh khô trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH đến 6,8 sau khi thanh trùng, nếu cần.
Thanh trùng trong nồi hấp áp lực (6.1) ở 121oC trong 20 phút.
B.7.2 Dung dịch ure
B.7.2.1 Thành phần
Ure | 400 g |
Nước, đủ để có thể tích cuối cùng | 1 000 ml |
B.7.2.2 Chuẩn bị
Hoà tan ure trong nước.
Thanh trùng bằng phương pháp lọc và kiểm tra độ vô trùng.
(Chi tiết của kỹ thuật lọc thanh trùng, xem trong bất cứ sách vi sinh vật học thích hợp nào).
B.7.3 Môi trường hoàn chỉnh
B.7.3.1 Thành phần
Môi trường cơ bản (B.7.1) | 950 ml |
Dung dịch ure (B.7.2) | 50 ml |
B.7.3.2 Chuẩn bị
Trong điều kiện vô trùng cho dung dịch ure vào môi trường cơ bản đã được làm chảy và sau đó để nguội đến 45oC ± 1oC.
Chia từng lượng 10 ml môi trường hoàn chỉnh vào các ống nghiệm vô trùng.
Đặt nghiêng các ống nghiệm.
B.8 Môi trường L - Lysin decacboxyl
B.8.1 Thành phần
L-Lysin monohydroclorua | 5,0 g |
Chất chiết nấm | 3,0 g |
Glucoza | 1,0 g |
Tím bromocresol | 0,015 g |
Nước | 1 000 ml |
B.8.2 Chuẩn bị
Hoà tan các thành phần trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH đến 6,8 sau khi thanh trùng, nếu cần.
Chuyển từng lượng 5 ml môi trường vào các ống nuôi cấy hẹp (6.10).
Thanh trùng trong nồi hấp áp lực (6.1) ở 121oC trong 10 phút.
B.9 Thuốc thử β-Galactosidaze
B.9.1 Dung dịch đệm
B.9.1.1 Thành phần
Natri dihydro phosphat (NaH2PO4) | 6,9 g |
Natri hydroxyt, dung dịch 10 mol/l | khoảng 3 ml |
Nước, đủ để có thể tích cuối cùng | 50 ml |
B.9.1.2 Chuẩn bị
Hoà tan natri dihydro phosphat trong bình định mức với khoảng 45 ml nước.
Chỉnh pH đến 7,0 bằng dung dịch natri hydroxit.
Thêm nước đủ để có thể tích cuối cùng 50 ml.
B.9.2 Dung dịch ONPG
B.9.2.1 Thành phần
o-Nitrophenyl (β-o-galactopyranoside (ONPG) | 0,08 mg |
Nước | 15 ml |
B.9.2.2 Chuẩn bị
Hoà tan ONPG trong nước ở 50oC ± 1oC.
Để nguội dung dịch.
B.9.3. Thuốc thử hoàn chỉnh
B.9.3.1 Thành phần
Dung dịch đệm (B.9.1) | 5 ml |
Dung dịch ONPG (B.9.2) | 15 ml |
B.9.3.2 Chuẩn bị
Cho dung dịch đệm vào dung dịch ONPG.
B.10 Thuốc thử phản ứng Voges-Proskauer (VP)
B.10.1 Môi trường VP
B. 10.1.1 Thành phần
Pepton | 7,0 g |
Glucoza | 5,0 g |
Dikali hydro phosphat (K2HPO4) | 5,0 g |
Nước | 1 000 ml |
B. 10.1.2 Chuẩn bị
Hoà các thành phần trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH đến 6,9 sau khi thanh trùng, nếu cần.
Chuyển 3 ml môi trường vào một số ống nghiệm.
Thanh trùng trong nồi hấp áp lực (6.1) ở 115oC trong 20 phút.
B.10.2. Dung dịch creatin (N-amidinosacosin)
B.10.2.1 Thành phần
Creatin ngậm 1 phân tử nước | 0,5 g |
Nước | 100 ml |
B.10.2.2 Chuẩn bị
Hoà tan creatin ngậm 1 phân tử nước trong nước.
B.10.3 1- Naphtol, pha trong dung dịch cồn etylic
B.10.3.1 Thành phần
1-naphtol | 6 g |
Cồn etylic, 96% (V/V) | 100 ml |
B.10.3.2 Chuẩn bị
Hoà tan 1- naphtol trong cồn etylic.
B.10.4 Dung dịch kali hidroxit
10.4.1. Thành phần
Kali hidroxit | 40 g |
Nước | 100 ml |
B.10.4.2 Chuẩn bị
Hoà tan kali hidroxit trong nước
B.11 Thuốc thử phản ứng indol
B.11.1 Môi trường tryptophan/trypton
B.11.1.1 Thành phần
Trypton | 10 g |
Natri clorua | 5 g |
DL-Tryptophan | 1 g |
Nước | 1 000 ml |
B.11.1.2 Chuẩn bị
Hoà tan các thành phần trong nước ở 100oC.
Chỉnh pH đến 7,5 sau khi thanh trùng, nếu cần.
Chuyển 5 ml môi trường vào một số ống nghiệm.
Thanh trùng trong nồi hấp áp lực (6.1) ở 121oC trong 15 phút.
B.11.2 Thuốc thử Kovacs
B.11.2.1 Thành phần
4-Dimethylaminobenzaldehyt | 5 g |
Axit clohydric, p = 1,18 -1,19 g/ml | 25 ml |
2-metylbutan-2-ol | 75 ml |
B.11.2.2 Chuẩn bị
Trộn lẫn các thành phần.
B.12 Thạch dinh dưỡng bán đặc
B.12.1 Thành phần
Cao thịt | 3,0 g |
Pepton | 5,0 g |
Thạch | 4 g đến 9 g1) |
Nước | 1 000 ml |
1) phụ thuộc vào sức đông của thạch | |
B.12.2. Chuẩn bị
Hoà tan natri clorua trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH đến 7,0 sau khi thanh trùng, nếu cần.
Chuyển môi trường vào các bình có dung tích thích hợp.
Thành trùng ở 121oC trong 20 phút.
B.12.3. Chuẩn bị đĩa thạch
Cho vào mỗi đĩa Petri nhỏ đã thanh trùng (6.13) khoảng 15 ml môi trường mới chuẩn bị. Đĩa thạch chưa cần làm khô.
B.13. Dung dịch muối
B.13.1. Thành phần
Natri clorua | 8,5 g |
Nước | 1 000 ml |
B.13.2. Chuẩn bị
Hoà tan natri clorua trong nước bằng cách đun nóng, nếu cần.
Chỉnh pH đến 7,0 sau khi thanh trùng, nếu cần.
Chia lượng dung dịch vào các bình sao cho có được 90 ml đến 100 ml sau khi thanh trùng.
Thanh trùng trong nồi hấp áp lực (6.1) ở 121oC trong 20 phút.
Phụ lục C
(Qui định)
Các yêu cầu kỹ thuật đối với lục sáng
C.1 Đặc tính vi khuẩn học
Loại bỏ sự lan truyền của proteus trên thạch đỏ phenol/lục sáng (5.2.4.1) trong khi không ức chế sự sinh trưởng của Salmonella.
C.2 Phương pháp thử
C.2.1 Môi trường
Chuẩn bị thạch đỏ phenol/lục sáng theo B.4 nhưng với các nồng độ lục sáng khác nhau từ 4,5 mg/l đến 6 mg/l.
C.2.2 Cách tiến hành
Cấy chất nuôi cấy thuần khiết Proteus lên một loạt các đĩa thạch có các nồng độ lục sáng khác nhau và một loạt tương tự đĩa với chất nuôi cấy Salmonella, và nuôi cấy các đĩa này ở 35oC hoặc 37oC (theo thoả thuận) không quá 24 h.
Nồng độ lục sáng thích hợp sẽ làm Salmonella phát triển với những khuẩn lạc điển hình màu hồng, đường kính 1 mm đến 2 mm, và ức chế sự phát triển của Proteus; có nghĩa là không có sự lan truyền của Proteus.
Nồng độ lục sáng như trên được sử dụng để chuẩn bị dung dịch lục sáng (xem B.4.3).
Phụ lục D
(Tham khảo)
Phương pháp tiêu chuẩn ria cấy đĩa môi trường thạch