Nội dung toàn văn Tiêu chuẩn quốc gia TCVN 7785:2007 (ISO 14674:2005) về Sữa và sữa bột - Xác định hàm lượng aflatoxin M1 - Làm sạch bằng sắc ký ái lực miễn dịch và xác định bằng sắc ký lớp mỏng
TIÊU CHUẨN QUỐC GIA
TCVN 7785:2007
ISO 14674:2005
SỮA VÀ SỮA BỘT - XÁC ĐỊNH HÀM LƯỢNG AFLATOXIN M1 - LÀM SẠCH BẰNG SẮC KÝ ÁI LỰC MIỄN DỊCH VÀ XÁC ĐỊNH BẰNG SẮC KÝ LỚP MỎNG
Milk and powder - Determination of aflatoxin M1 content -
Clean-up by immunoaffinity chromatography and determination by thin-layer chromatography
Lời nói đầu
TCVN 7785:2007 hoàn toàn tương với ISO 14674:2005;
TCVN 7785:2007 do Ban kỹ thuật tiêu chuẩn TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
SỮA VÀ SỮA BỘT
XÁC ĐỊNH HÀM LƯỢNG AFLATOXIN M1 - LÀM SẠCH BẰNG SẮC KÝ ÁI LỰC MIỄN DỊCH VÀ XÁC ĐỊNH BẰNG SẮC KÝ LỚP MỎNG
Milk and powder - Determination of aflatoxin M1 content - Clean-up by immunoaffinity chromatography and determination by thin-layer chromatography
CẢNH BÁO - Phương pháp quy định trong tiêu chuẩn này có sử dụng đến các dung dịch aflatoxin M1. Aflatoxin là chất gây ung thư cho người. Cần chú ý tới thông báo của Tổ chức nghiên cứu ung thư Quốc tế (WHO) [5].
Aflatoxin bị suy giảm chất lượng dưới ánh sáng. Cần triển khai kỹ thuật phân tích này tránh ánh sáng mặt trời và bảo vệ các dung dịch chuẩn aflatoxin tránh ánh sáng, ví dụ: sử dụng lọ màu hổ phách hoặc bọc trong giấy nhôm.
Sử dụng các dụng cụ thủy tinh (ví dụ: lọ, ống nghiệm, bình) chưa được rửa bằng axit dùng để đựng các dung dịch aflatoxin có thể làm thất thoát aflatoxin. Đặc biệt cẩn thận với dụng cụ thủy tinh mới. Trước khi sử dụng, ngâm các dụng cụ thủy tinh mới vài giờ trong axit loãng (ví dụ: axit sulfuric 2 mol/l), rồi tráng kỹ bằng nước cất để loại bỏ hết các vết axit. Kiểm tra bằng giấy đo phù hợp để đảm bảo là pH trong khoảng từ 6 đến 8.
Sử dụng quy trình khử nhiễm đối với chất thải phòng thử nghiệm đã được Cơ quan Nghiên cứu Ung thư Quốc tế (WHO) [5] xây dựng và đánh giá xác nhận.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định hàm lượng aflatoxin M1 (AFM1) trong sữa bột bằng phương pháp bao gồm bước làm sạch bằng sắc ái lực miễn dịch rồi đo bằng sắc ký lớp mỏng (IAC-TLC).
Phương pháp này có thể áp dụng cho sữa nguyên liệu, có hàm lượng chất béo thấp hoặc sữa gầy, sữa dạng lỏng và sữa bột.
Lượng AFM1 thấp nhất thông thường có thể xác định được là 2 ng, tương ứng với giới hạn định lượng 0,10 mg/l đối với sữa dạng lỏng hoặc sữa bột pha (đối với điểm chấm 20 ml).
2. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng thuật ngữ và định nghĩa sau đây:
2.1.
Hàm lượng aflatoxin M1 (aflatoxin M1 content)
Phần khối lượng của chất xác định được bằng phương pháp quy định trong tiêu chuẩn này.
CHÚ THÍCH Hàm lượng aflatoxin M1 được biểu thị bằng microgam trên lít đối với sản phẩm sữa dạng lỏng và microgam trên kilogam đối với sữa bột.
3. Nguyên tắc
Aflatoxin M1 (AFM1) được chiết tách bằng cách cho phần mẫu thử đi qua cột sắc ký ái lực miễn dịch. Cột này có chứa các kháng thể đặc thù liên kết với chất phụ trợ rắn. Khi mẫu thử đi qua cột thì các kháng thể sẽ liên kết chọn lọc với bất kỳ AFM1 nào (kháng nguyên) có mặt và tạo ra một phức kháng nguyên-kháng thể. Tất cả các thành phần khác của chất nền mẫu được rửa sạch khỏi cột bằng nước. Sau đó AFM1 được rửa giải ra khỏi cột bằng metanol và axetonitril. Sau khi cô đặc chất rửa giải, hàm lượng AFM1 được xác định bằng sắc kí lớp mỏng một chiều. Trong trường hợp có nhiễu, thực hiện sắc kí lớp mỏng hai chiều để tách AFM1 ra khỏi tạp chất.
4. Thuốc thử
Tất cả thuốc thử được sử dụng phải thuộc loại phân tích, trừ khi có quy định khác, và nước cất hoặc nước đã khử khoáng hoặc nước có độ tinh khiết tương đương.
4.1. Dung môi tinh khiết.
CẢNH BÁO - Một số dung môi tinh khiết (ví dụ: clorofom, axetonitril, toluen và metanol) là các chất độc. Cẩn thận trong khi sử dụng chúng.
4.1.1. Clorofom (CHCl3).
4.1.2. Exetonitril (CH3CN).
4.1.3. Ete dietyl [(C2H5)2O].
4.1.4. Metanol (CH3OH).
4.1.5. Toluen (C6H5CH3).
4.1.6. Axeton (CH3COCH3), tùy chọn
4.1.7. Isopropanol (CH3CHOHCH3), tùy chọn.
4.2. Dung dịch axetonitril/metanol, tỷ lệ thể tích 3:2
Cho 30 ml axetonitril (4.1.2) vào 20 ml metanol (4.1.4) và trộn.
4.3. Dung dịch toluene/axetonitril, tỷ lệ thể tích 9:1
Cho 9 ml toluen (4.1.5) và 1 ml axetonitril (4.1.2) và trộn. Sử dụng dung dịch này để hòa tan các dung dịch chuẩn AFM1 (4.5) và chất rửa giải đã cho bay hơi trước khi phân tích TLC.
4.4. Dung môi phát triển TLC
4.4.1. Dung dịch TLC một chiều
Chuẩn bị 100 ml dung dịch TLC một chiều, bằng cách cho vào 95 ml ete dietyl (4.1.3) 1 ml nước và 4 ml metanol (4.1.4) và lắc trộn đều (tỷ lệ thể tích là 95:1:4).
4.4.2. Dung dịch TLC hai chiều, tùy chọn
Chuẩn vị 100 ml dung dịch TLC hai chiều bằng cách cho vào 87 ml clorofom (4.1.1) 3 ml isopropanol (4.1.7) và 10 ml axeton (4.1.6) và lắc trộn đều (tỷ lệ thể tích 87:3:10).
4.5. Dung dịch chuẩn aflatoxin M1
4.5.1. Dung dịch chuẩn gốc AFM1.
Chuẩn bị dung dịch chuẩn gốc AFM1 có nồng độ danh định là 10 mg/ml clorofom (4.1.1); nghĩa là bằng cách hòa lại màng lyophilized 10 mg AFM1 trong 1 ml clorofom.
Xác định nồng độ của dung dịch chuẩn gốc AFM1 theo AOAC [6], bằng cách đo độ hấp thụ của dung dịch này tại bước sóng hấp thụ tối đa và sử dụng máy đo quang phổ đã hiệu chuẩn để ghi lại độ hấp thụ của dung dịch chuẩn gốc so với clorofom (4.1.1), được dùng làm dung dịch mẫu trắng, ở bước sóng từ 200 nm đến 400 nm.
Kiểm tra độ tinh khiết của AFM1 bằng cách ghi lại sắc phổ ở bước sóng từ 200 nm đến 400 nm. Đo độ hấp thụ (A) tại bước sóng có độ hấp thụ tối đa (lmax), nghĩa là gần với 365 nm.
Tính nồng độ khối lượng, c, được biểu thị bằng microgam trên mililít, theo công thức sau:
c = A x M x 100/e
trong đó
A là giá trị bằng số của độ hấp thụ đo đươc tại lmax;
M là giá trị bằng số của phân tử lượng AFM1, tính bằng gam trên mol (M = 328 g/mol);
e là giá trị bằng số của hệ số hấp thụ AFM1 trong clorofom, tính bằng mét vuông trên mol (e = 1 995 m2.mol-1)
Giữ dung dịch chuẩn gốc AFM1 trong lọ màu hổ phách có nắp đậy kín tránh ánh sáng. Bảo quản dung dịch gốc ở nhiệt độ dưới 0 oC. Dung dịch chuẩn gốc AFM1 có thể bền được một năm khi được bảo quản trong các điều kiện này.
4.5.2. Dung dịch chuẩn làm việc AFM1
4.5.2.1. Dung dịch làm việc A
Dùng pipet định mức hoặc microxyanh Hamilton (5.2) chuyển 50 ml dung dịch chuẩn gốc AFM1 (4.5.1) cho vào lọ. Cho bay hơi dung dịch đến khô. Hòa lại dung dịch khô bằng 50 ml dung dịch toluen/axetonitril (4.3) để thu được dung dịch chuẩn làm việc AFM1 có nồng độ 1 mg/ml (dung dịch làm việc A). Sử dụng dung dịch A để chấm lên các tấm TLC đối với các mẫu thử có mức nhiễm cao hoặc khi mức xác định gần với 0,50 mg/l.
4.5.2.2. Dung dịch làm việc B
Chuyển 100 ml dung dịch A vào lọ. Thêm 900 ml dung dịch toluen/axetonitril (4.3) để thu được dung dịch chuẩn làm việc AFM1 có nồng độ 0,1 mg/ml (dung dịch làm việc B). Sử dụng dung dịch B để chấm lên các tấm TLC đối với các mẫu thử có mức nhiễm thấp hoặc khi mức xác định gần với 0,1 mg/l
5. Thiết bị, dụng cụ
Sử dụng các thiết bị phòng thử nghiệm thông thường và cụ thể như sau:
5.1. Pipet định mức, có các dung tích yêu cầu.
5.2. Microxyranh Hamilton. 1)
5.3. Dụng cụ thủy tinh phòng thử nghiệm, như cốc có mỏ và phễu thủy tinh có dung tích thích hợp.
5.4. Bình định mức một vạch, dung tích 200 ml.
5.5. Ống đong, dung tích 100 ml.
5.6. Xyranh sử dụng một lần, dung tích 10 ml và 100 nl.
5.7. Ống hình nón bằng thủy tinh, dung tích 5 ml để đựng dịch chiết sau bước làm sạch.
5.8. Hệ thống làm bay hơi, bộ cất quay hoặc sử dụng dòng khí nitơ nhẹ.
5.9. Máy đo phổ, có thể đo được ở bước sóng từ l = 200 nm đến l = 400 nm, có các cuvet mặt thạch anh với chiều dài đường quang 1 cm.
5.10. Nồi cách thủy, có khả năng vận hành nhiệt độ từ 35 oC đến 37 oC.
5.11. Máy ly tâm, có khả năng tạo gia tốc quay ít nhất 2 000 g và nếu có thể ở + 4 oC là tốt nhất.
5.12. Giấy lọc (loại Whatman No.4 1), hoặc tương đương).
5.13. Cột ái lực
Các cột ái lực miễn dịch phải chứa các kháng thể kháng AFM1. Các cột phải này có dung tích tối đa không nhỏ hơn 100 ng AFM1 (tương ứng với 1 mg/l hoặc 10 mg/kg khi áo dụng phần mẫu thử 100 ml). Các cột này phải có độ thu hồi không nhỏ hơn 80 % AFM1 khi dùng dung dịch hiệu chuẩn chứa 4 ng độc tố (tương ứng với 0,04 mg/l hoặc 0,40 mg/kg khi áp dụng phần mẫu thử 100 ml). Mọi cột ái lực miễn dịch đáp ứng yêu cầu tính năng nói trên đều có thể được sử dụng.
5.14. Cân phân tích, có thể cân chính xác đến 0,1 g.
5.15. Máy khuấy từ.
5.16. Máy khuấy dạng Vortex.
5.17. Hệ thống chân không, dùng cho ống ái lực miễn dịch.
5.18. Tủ sấy, có khả năng duy trì nhiệt độ ở khoảng 50 oC.
5.19. Hộp sắc ký lớp mỏng (TLC).
5.20. Tấm sắc ký lớp mỏng (TLC), bằng thủy tinh hoặc nhôm, có bề mặt 10 cm x 10 cm hoặc 20 cm x 20 cm, có silica gel 60.
5.21. Đèn UV, có thể hoạt động ở 365 nm.
5.22. Máy đo mật độ quang (tùy chọn)
6. Lấy mẫu
Điều quan trọng là mẫu gửi đến phòng thử nghiệm phải đúng mẫu đại diện và không bị hư hỏng hoặc thay đổi trong quá trình vận chuyển hoặc bảo quản.
Việc lấy mẫu không quy định trong tiêu chuẩn này. Nên lấy mẫu theo TCVN 6400 (ISO 707).
7. Chuẩn bị mẫu thử
7.1. Sữa hoặc sản phẩm sữa dạng lỏng
Làm ấm mẫu thử trên nồi cách thủy (5.10) ở nhiệt độ từ 35 oC đến 37 oC để hòa tan lớp chất béo để thu được mẫu thử đồng nhất khi trộn nhẹ.
Ly tâm mẫu thử đã đồng nhất ở gia tốc ly tâm 2 000 g ít nhất 15 min. Làm nguội mẫu để tách lớp chất béo tốt hơn và gạn lớp mỏng chất béo phía trên, nếu có thể. Lọc qua một hoặc nhiều lớp giấy lọc (5.12), nếu cần. Thu lấy ít nhất 100 ml phần mẫu thử đã được chuẩn bị như vậy.
7.2. Sữa bột
Cân 20,0 g mẫu, chính xác đến 0,1 g cho vào cốc có mỏ dung tích 250 ml (5.2). Hòa tan mẫu thử bằng 150 ml nước đã được làm ấm từ 50 oC đến 60 oC. Dùng máy khuấy từ (5.15) để trộn dung tích thu được trong 10 min.
Để nguội dung dịch đến nhiệt độ phòng. Sau đó chuyển hết sang một bình định mức 200 ml (5.4). Pha loãng bằng nước đến vạch mức. Đậy nắp bình và lắc kỹ để thu được dung dịch mẫu thử đồng nhất.
Ly tâm bằng máy (5.11) dung dịch thử ở gia tốc ly tâm 2 000g trong 15 min. Làm nguội dung dịch để tách lớp chất béo tốt hơn và gạn lớp chất béo phía trên, nếu có thể. Lọc qua một hoặc nhiều lớp giấy lọc (5.12), nếu cần. Thu lấy ít nhất 100 ml phần mẫu thử đã được chuẩn bị như vậy.
7.3. Làm sạch cột ái lực miễn dịch
Cho cột ái lực miễn dịch (5.13) đạt đến nhiệt độ phòng. Gắn xyranh lên đỉnh ống ái lực miễn dịch. Sử dụng ống đong 100 ml (5.5) hoặc pipet lấy 100 ml phần mẫu thử đã chuẩn bị (7.1 hoặc 7.2).
Chuyển phần mẫu thử vào xyranh và để cho đi qua cột ái lực miễn dịch ở tốc độ chậm ổn định khoảng 2 ml/min đến 3 ml/min. Sử dụng lực hút hoặc hệ thống chân không (5.17) để khống chế tốc độ dòng. Không để cột chảy đến khô. Rửa cột bằng 40 ml nước với tốc độ dòng ổn định. Sau khi rửa, thổi khô cột và gạn bỏ dung dịch rửa.
Đặt một xyranh sạch khác lên ống. Rửa giải chậm AFM1 ra khỏi cột bằng cách cho 2,5 ml dung dịch axetonitril/metanol (4.2) và tiếp đó 2,5 ml metanol tinh khiết (4.1.4) đi qua. Để cho các dung môi này tiếp xúc với cột ít nhất 1 min trong khi vẫn giữ tốc độ dòng ổn định. Sau đó thổi khô cột.
Thu lấy dịch rửa giải vào ống hình nón và cho bay hơi đến gần khô (nghĩa là đến giọt cuối cùng) bằng bộ cất quay (5.8) ở nhiệt độ £ 40 oC hoặc sử dụng một luồng khí nitơ nhẹ. Không làm bay hơi đến khô hẳn để cho phép tái huyền phù tốt AFM1 có mặt trong cặn của mẫu thử.
Thêm 200 ml axetonitril tinh khiết (4.1.2) vào phần cận của phần mẫu thử. Đóng nắp ống và trộn, tốt nhất là dùng máy khuấy từ dạng Vortex (5.16), lắc mạnh trong 1 min. Cho bay hơi lại đến gần khô (nghĩa là đến giọt cuối cùng) bằng cách sử dụng bộ cất quay (5.8) ở nhiệt độ £ 40 oC hoặc sử dụng luồng khí nitơ nhẹ.
CHÚ THÍCH Bước đầu là cần thiết để tránh tạo nhũ và để thu được tái huyền phù tốt khi thêm dung dịch toluen/axetonitril.
Mở ống và cho 100 ml dung dịch toluen/axetonitril (4.3) vào phần cặn của mẫu thử. Đóng nắp ống và lắc trộn, tốt nhất là dùng máy khuấy từ dạng Vortex (5.16), lắc mạnh trong 1 min. Bảo quản phần mẫu thử đã làm sạch này cho đến khi bắt đầu phân tích.
8. Cách tiến hành
8.1. Sắc ký lớp mỏng một chiều
Chấm lên tấm sắc ký lớp mỏng (5.20) một chấm từ 10 ml đến 20 ml dung dịch thử đã làm sạch (7.3). Thêm, ví dụ: các phần 5 ml, 10 ml và 20 ml dung dịch chuẩn làm việc AFM1 đã chuẩn bị theo 4.5.2 (dung dịch A hoặc dung dịch B).
Đặt tấm này vào hộp sắc ký lớp mỏng (5.19) chứa dung dịch sắc ký lớp mỏng một chiều (4.4.1). Cho hiện sắc ký cho đến khi dung môi đạt chiều cao khoảng 10 cm.
Lấy tấm sắc ký ra khỏi hộp và để khô trong không khí. Đọc các điểm chấm thu được sử dụng đèn UV (5.21) ở bước sóng 365 nm hoặc máy đo mật độ quang (5.22) ở bước sóng 365 nm. So sánh cường độ huỳnh quang của điểm chấm mẫu thử với cường độ huỳnh quang của các điểm chấm dung dịch chuẩn làm việc AFM1. Các điểm chấm cũng có thể được so sánh với điểm phát sáng cận kề.
Tính hàm lượng AFM1 trong phần mẫu thử theo điều 9.
Nếu huỳnh quang của điểm chấm của phần mẫu thử mạnh hơn huỳnh quang của dung dịch chuẩn làm việc AFM1 cao nhất thì ước tính mức nhiễm bẩn. Dựa vào mức nhiễm này, pha loãng phần mẫu thử 7.3 với một thể tích thích hợp của dung dịch toluen/axetonitril (4.3).
Lặp lại quy trình với phần mẫu thử tinh sạch đã pha loãng theo 8.1.
8.2. Sắc ký lớp mỏng hai chiều
Nếu có bất kỳ sự nhiễu hoặc xuất hiện vạch trong tấm sắc ký đã hiện gần với các điểm huỳnh quang, thì tiến hành chạy sắc ký lớp mỏng hai chiều. Chấm lên tấm sắc ký lớp mỏng (5.20) 20 ml phần thử đã tinh sạch (7.3). Chấm thêm các điểm 5 ml, 10 ml và 20 ml dung dịch chuẩn làm việc AFM1 (4.5.2) để chạy theo hướng 1 và các điểm chấm 5 ml và 10 ml của cùng dung dịch chuẩn làm việc AFM1 (4.5.2) chạy theo hướng 2 (xem hình 1).
Đặt tấm sắc ký vào hộp TLC (5.19) chứa dung dịch TLC một chiều (4.1.1). Cho hiện sắc ký trong hướng 1 cho đến khi dung môi đạt đến chiều cao khoảng 7 cm. Lấy tấm sắc ký ra khỏi hộp và để khô trong không khí.
Làm nóng tấm sắc ký khô trong tủ sấy (5.18) đật ở 50 oC trong 5 min. Để nguội và đặt tấm này theo hướng thứ hai chiều xuống dưới vào hộp TLC (5.19) khác có chứa dung dịch TLC hai chiều (4.4.2). Cho hiện sắc ký tấm này trong hướng thứ hai cho đến khi dung môi đạt chiều cao khoảng 7 cm.
Lấy tấm sắc ký ra khỏi hộp và để khô trong không khí. Đọc các điểm chấm thu được sử dụng đèn UV (5.21) ở bước sóng 365 nm hoặc bằng máy đo mật độ quang (5.22) ở 365 nm. So sánh cường độ huỳnh quang của điểm chấm mẫu với cường độ huỳnh quang của các điểm chấm dung dịch chuẩn làm việc AFM1. Các điểm chấm này cũng có thể được so sánh với điểm phát sáng cận kề.
Tính hàm lượng AFM1 trong phần mẫu thử theo điều 9.
Nếu huỳnh quang của điểm chấm của phần mẫu thử mạnh hơn huỳnh quang của dung dịch chuẩn làm việc AFM1 thì lặp lại quy trình với phần nhỏ hơn của mẫu thử tinh sạch (7.4), bắt đầu lại theo 8.2.
Sau kho phân tích TLC, bảo quản dung dịch thử đã tinh sạch còn lại trong lọ đậy kín trong tủ đá để định lượng hoặc khẳng định nhận dạng tiếp theo, nếu cần.
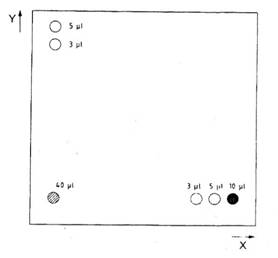
Chú giải
X Hướng 2
Y Hướng 1
Hình 1 - Sắc ký lớp mỏng hai chiều
9. Tính toán và biểu thị kết quả
9.1. Tính toán
Tính phần khối lượng AFM1 trong mẫu thử (7.1 hoặc 7.2), wA, bằng microgam trên lít hoặc microgam trên kilogam theo công thức sau:
wA = ![]()
trong đó
vs là giá trị bằng số của thể tích điểm chấm của dung dịch chuẩn làm việc AFM1 dung dịch A hoặc B (4.5.2), có thể so sánh với điểm chấm của mẫu thử (8.1 hoặc 8.2) và được dùng để tính toán, tính bằng microlít;
Cs là hàm lượng AFM1 của dung dịch chuẩn làm việc A hoặc B (4.5.2) có thể so sánh với điểm chấm của phần mẫu thử (8.1 hoặc 8.2) và được dùng để tính toán, tính bằng nanogam trên microlít;
v1 là thể tích của cặn hòa tan, tính bằng microlít (v1 = 100 ml);
v2 là thể tích của điểm chấm (8.1 hoặc 8.2) phần mẫu đã tinh sạch có thể so sánh với điểm chấm của dung dịch chuẩn làm việc A hoặc B (4.5.2) và được sử dụng để tính toán, tính bằng microlít;
mt là thể tích (7.1) hoặc khối lượng (7.2) của mẫu thử, tính bằng microlít hoặc gam.
9.2. Biểu thị kết quả
Biểu thị kết quả đến hai chữ số thập phân.
10. Độ chụm
10.1. Phép thử liên phòng thử nghiệm
Các chi tiết của phép thử nghiệm liên phòng thử nghiệm về độ chụm của phương pháp được nêu trong phụ lục A. Các giá trị thu được từ phép thử liên phòng thử nghiệm này có thể không áp dụng được cho các dải nồng độ và chất nền khác với các giá trị đã nêu.
10.2. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm riêng rẽ độc lập thu được, khi sử dụng cùng phương pháp thử trên vật liệu thử giống hệt nhau, do cùng một người phân tích sử dụng cùng một thiết bị, tiến hành trong cùng một phòng thử nghiệm, trong một khoảng thời gian ngắn, không quá 5% các trường hợp sau đây:
a) Đối với mẫu dạng lỏng
- với mức nhiễm thấp (± 0,10 mg/l), các kết quả chưa hiệu chỉnh: 0,17 mg/l;
- với mức nhiễm thấp (± 0,10 mg/l), đã hiệu chỉnh về độ thu hồi: 0,10 mg/l;
- với mức nhiễm cao (± 0,50 mg/l), chưa hiệu chỉnh: 0,63 mg/l;
- với mức nhiễm cao (± 0,50 mg/l), đã hiệu chỉnh về độ thu hồi: 0,96 mg/l.
b) Đối với mẫu dạng bột
- với mức nhiễm thấp (± 1,00 mg/kg), chưa hiệu chỉnh: 0,73 mg/kg;
- với mức nhiễm thấp (± 1,00 mg/kg), đã hiệu chỉnh về độ thu hồi: 1,04 mg/kg;
- với mức nhiễm cao (± 5,00 mg/kg), chưa hiệu chỉnh: 3,04 mg/kg;
- với mức nhiễm cao (± 5,00 mg/kg), đã hiệu chỉnh về độ thu hồi: 5,79 mg/kg.
10.3. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử nghiệm riêng rẽ thu được, khi sử dụng cùng phương pháp thử trên vật liệu thử giống hệt nhau, do các người phân tích khác nhau thực hiện trong các phòng thử nghiệm khác nhau, sử dụng các thiết bị khác nhau, không quá 5% các trường hợp lớn hơn các giá trị sau đây:
a) Đối với mẫu dạng lỏng
- với mức nhiễm thấp (± 0,10 mg/l), chưa hiệu chỉnh: 0,18 mg/l;
- với mức nhiễm thấp (± 0,10 mg/l), đã hiệu chỉnh về độ thu hồi: 0,14 mg/l;
- với mức nhiễm cao (± 0,50 mg/l), chưa hiệu chỉnh: 0,84 mg/l;
- với mức nhiễm cao (± 0,50 mg/l), đã hiệu chỉnh về độ thu hồi: 0,96 mg/l.
b) Đối với mẫu dạng bột
- với mức nhiễm thấp (± 1,00 mg/kg), chưa hiệu chỉnh: 1,01 mg/kg;
- với mức nhiễm thấp (± 1,00 mg/kg), đã hiệu chỉnh về độ thu hồi: 1,25 mg/kg;
- với mức nhiễm cao (± 5,00 mg/kg), chưa hiệu chỉnh: 5,06 mg/kg;
- với mức nhiễm cao (± 5,00 mg/kg), đã hiệu chỉnh về độ thu hồi: 8,63 mg/kg.
11. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
a) mọi thông tin cần thiết về việc nhận biết đầy đủ mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử đã sử dụng, theo tiêu chuẩn này;
d) mọi chi tiết thao tác không quy định trong tiêu chuẩn này, cùng với các chi tiết bất thường nào khác có thể ảnh hưởng tới kết quả.
e) kết quả thử nghiệm thu được, hoặc nếu đáp ứng được yêu cầu về độ lặp lại, thì nêu kết quả cuối cùng thu được.
Phụ lục A
(tham khảo)
Kết quả thử liên phòng thử nghiệm
Một phép thử liên phòng thử nghiệm gồm chín phòng thử nghiệm trên các mẫu sữa dạng lỏng và mười một phòng thử nghiệm trên mẫu sữa bột, được thực hiện trên các mẫu kép. Các mẫu thử dạng lỏng bị nhiễm ở hai mức: ở 0,13 mg/l (L1) và ở 0,68 mg/l (L2). Các mẫu sữa bột cũng bị nhiễm ở hai mức: ở 1,17 mg/kg (P1) và ở 5,49 mg/kg (P2). Phân tích thống kê đã được tiến hành trên các kết quả chưa hiệu chỉnh và trên các kết quả đã hiệu chỉnh về độ thu hồi.
AFSSA-LERHQA, Pháp đã tổ chức phép thử này. Hàm lượng AFM1 của sữa bị nhiễm được phân phối đã được xác định bằng phương pháp HPLC được quy định trong TCVN 6685 (ISO 14501).
Các kết quả thu được đã được phân tích thống kê phù hợp với TCVN 6910-1 (ISO 5725-1) và TCVN 6910-2 (ISO 5725-2) cho dữ liệu về độ chụm như trong Bảng A.1.
Bảng A.1 - Các kết quả của phép thử liên phòng thử nghiệm (dữ liệu chưa hiệu chỉnh)
| Các mẻ | |||||||
L1 | L2 | P1 | P2 | |||||
Aa | Bb | Aa | Bb | Aa | Bb | Aa | Bb | |
Các giá trị dự đoán (mg/l hoặc mg/kg) | 0,13 | 0,13 | 0,68 | 0,68 | 1,17 | 1,17 | 5,49 | 5,49 |
Số lượng phòng thử nghiệm | 9 | 8 | 11 | 11 | 9c | 10 | 11 | 10d |
Giá trị trung bình (mg/l hoặc mg/kg) | 0,13 | 0,14 | 0,46 | 0,63 | 0,65 | 0,93 | 3,36 | 5,74 |
Độ lệch chuẩn lặp lại, sr (mg/l hoặc mg/kg) | 0,06 | 0,04 | 0,22 | 0,34 | 0,26 | 0,37 | 1,08 | 2,04 |
Độ lệch chuẩn tương đối lặp lại (%) | 45,10 | 25,90 | 48,70 | 54,10 | 40,10 | 39,30 | 32,00 | 35,60 |
Giới hạn lặp lại ở 95%, r (mg/l hoặc mg/kg) | 0,17 | 0,10 | 0,63 | 0,96 | 0,73 | 1,04 | 3,04 | 5,79 |
Độ lệch chuẩn tái lập, sR (mg/l hoặc mg/kg) | 0,06 | 0,05 | 0,25 | 0,30 | 0,36 | 0,44 | 1,79 | 3,05 |
Độ lệch chuẩn tương đối tái lập (%) | 49,00 | 33,70 | 55,10 | 46,90 | 55,40 | 47,50 | 53,30 | 53,10 |
Giới hạn tái lập ở 95%, R (mg/l hoặc mg/kg) | 0,18 | 0,14 | 0,72 | 0,84 | 1,01 | 1,25 | 5,06 | 8,63 |
a A là số liệu chưa hiệu chỉnh. b B là số liệu đã hiệu chỉnh về độ thu hồi. c Số liệu từ phòng thử nghiệm số 7 cho thấy ngoại lệ đối với mẻ P1 bởi phép thử Cochran. d Số liệu từ phòng thử nghiệm số 4 cho thấy ngoại lệ đối với mẻ P2 bởi phép thử Cochran; số liệu từ phòng thử nghiệm số 6 cho thấy rời rạc đối với mẻ P2 bởi phép thử Cochran nhưng đã được bao gồm trong tính toán. | ||||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 6400 (ISO 707), Sữa và sản phẩm sữa - Hướng dẫn lấy mẫu.
[2] TCVN 6685 (ISO 14501) Sữa và sữa bột - Xác định hàm lượng aflatoxin M1 - Làm sạch bằng sắc ký chọn lọc và xác định bằng sắc ký lỏng hiệu năng cao (HPLC).
[3] TCVN 6910-1 (ISO 5725-1), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 1: Nguyên tắc và định nghĩa chung.
[4] TCVN 6910-2 (ISO 5725-2), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo. Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn.
[5] CASTEGNARO, M., HUNT, D.C., SANSONE, E.B., SCHULLER, P.L., SIRIWARDANA, M.G., TELLING, G.M., VAN EGMOND, H.P., WALKER, E.A. Laboratory decontamination and destruction of aflatoxins B1, B2, G1 and G2 in laboratory wastes. IARC Scientific Publication No 37, Int. Agency for Research on Cancer (WHO), Lyon (France), 1980, p.59.
[6] AOAC 1995 49.3.02 (980.21 Method).
1) Xyranh Hamilton và Whatman No.4 là các ví dụ về sản phẩm bán sẵn thích hợp. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và tổ chức tiêu chuẩn hóa Quốc tế không ấn định phải sử dụng chúng.



