Nội dung toàn văn Tiêu chuẩn quốc gia TCVN 8775:2011 (EPA METHOD 9132) về Chất lượng nước - Xác định coliform tổng số - Kỹ thuật màng lọc
TIÊU CHUẨN QUỐC GIA
TCVN 8775:2011
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH COLIFORM TỔNG SỐ - KỸ THUẬT MÀNG LỌC
Water quality - Total coliform - Membrane-filter technique
Lời nói đầu
TCVN 8775:2011 hoàn toàn tương đương với METHOD 9132 của Cơ quan Bảo vệ môi trường Hoa Kỳ (EPA METHOD 9132) với những thay đổi biên tập cho phép.
TCVN 8775:2011 do Ban kỹ thuật Tiêu chuẩn quốc gia TCVN/TC 147 Chất lượng nước biên soạn, Tổng Cục Tiêu chuẩn và Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Tiêu chuẩn này được xây dựng theo phương pháp tương đương có sửa đổi với METHOD 9132 của Cơ quan bảo vệ Môi trường Hoa Kỳ (EPA METHOD 9132). Trong đó phần nội dung tiêu chuẩn được bổ sung và sửa đổi như sau:
Bổ sung thêm tên của các tài liệu viện dẫn trong toàn bộ nội dung tiêu chuẩn để làm rõ thêm thông tin.
Bổ sung thêm chú thích trong 2.2 để giải thích thêm về quy trình làm giàu một bước (trực tiếp).
Bổ sung thêm chú thích trong 7.3.2 để cung cấp thêm thông tin về một số sản phẩm có sẵn trên thị trường có thể áp dụng cho tiêu chuẩn này.
Bỏ Điều 9 vì không có nội dung được đề cập.
Bổ sung thêm tên Hình 1 cho các sơ đồ và chuyển lên Điều 7 theo đúng nội dung được đề cập của quy trình và chỉnh sửa các số tham chiếu bị viện dẫn nhầm.
CHẤT LƯỢNG NƯỚC - XÁC ĐỊNH COLIFORM TỔNG SỐ - KỸ THUẬT MÀNG LỌC
Water quality - Total coliform - Membrane-filter technique
1. Phạm vi áp dụng
1.1. Phương pháp này được dùng để xác định số lượng nhóm coliform trong nước thải và nước ngầm.
1.2. Nhóm coliform được phân tích trong qui trình này bao gồm tất cả các vi khuẩn tạo ra khuẩn lạc có ánh kinh vàng-xanh trong 24 h nuôi cấy.
2. Tóm tắt phương pháp
2.1. Một lượng mẫu xác định được lọc qua màng lọc có khả năng giữ lại các vi khuẩn có trong mẫu.
2.2. Trong qui trình làm giàu hai bước, màng lọc có chứa vi khuẩn được đặt lên tấm hấp thụ bão hòa môi trường trytose lauryl, được ủ ở (35 ± 0,5) oC trong 2h. Sau đó, màng lọc được chuyển vào tấm hấp thụ bão hòa môi trường M-Endo hoặc lên đĩa chứa thạch M-Endo và ủ thêm khoảng (21 ± 1)h ở (35 ± 0,5) oC. Sau đó đếm các khuẩn lạc dưới thiết bị phóng đại (kính lúp hoặc kính hiển vi soi nổi) và ước lượng số coliform có trong 100 mL mẫu ban đầu.
CHÚ THÍCH: Trong qui trình làm giàu một bước, màng lọc chứa vi khuẩn được đặt vào trong môi trường nuôi cấy (M-Endo hoặc thạch M-Endo) và được ủ ở (35 ± 0,5) oC trong (23 ± 1) h. Sau đó đếm các khuẩn lạc dưới thiết bị phóng đại (kính lúp hoặc kính hiển vi soi nổi) và ước lượng số coliform có trong 100 mL mẫu ban đầu.
2.3. Các thao tác xử lý chi tiết hơn của phương pháp này được trình bày trong Phương pháp tiêu chuẩn để kiểm tra nước và nước thải và trong Phương pháp vi sinh để quan trắc môi trường [1]
3. Cản trở
3.1. Clo dư hoặc các halogen khác có thể cản trở hoạt động của vi khuẩn Natri thiosunfat được thêm vào để ngăn ngừa hiện tượng này.
3.2. Những mẫu nước có hàm lượng đồng, kẽm hoặc các kim loại nặng khác cao có thể gây độc cho vi khuẩn. Chỉ nên thêm các chất tạo chelat như axit etylendiamintetraaxetic (EDTA) khi nghi ngờ có kim loại nặng trong mẫu.
3.3. Độ đục của nước do tảo hoặc các cản trở khác có thể dẫn đến lọc không đủ lượng mẫu cần thiết để cho kết quả có ý nghĩa. Kết quả xác định số lượng coliform thấp hơn thực tế có thể do có mặt số lượng lớn loại không phải coliform hoặc chất độc.
3.4. Các mẫu có hàm lượng chất rắn lơ lửng cao sẽ gây cản trở đến sự phát triển của khuẩn lạc và ảnh hưởng đến việc khuẩn lạc trên màng lọc. Trong trường hợp này, sử dụng Method 9131. Total coliform - Muiltiple tube fermentation technique (Xác định coliform tổng số - Kỹ thuật lên men nhiều ống).
4. Thiết bị và vật liệu
4.1. Chai, cốc hoặc ống dùng để pha loãng
4.1.1. Sử dụng các chai, cốc hoặc ống thủy tinh trơ về mặt hóa học, nên dùng thủy tinh borosilicat có nút thủy tinh hoặc nút vặn để không tạo ra các chất độc hoặc chất ức chế vi khuẩn trong quá trình khử khuẩn.
4.1.2. Không sử dụng nút bằng bông hay vải cotton. Đánh dấu các vạch định mức trên mặt của ống hoặc chai không bị xóa hoặc rửa trôi trong quá trình pha loãng. Có thể sử dụng chai nhựa làm bằng vật liệu không độc hại và có kích thước phù hợp để thay thế cho chai thủy tinh, nếu được khử khuẩn phù hợp.
4.2. Pipet và ống đong chia độ
4.2.1. Sử dụng các pipet có kích thước thích hợp, miễn là chúng chuyển chính xác và nhanh thể tích mẫu theo yêu cầu. Sai số hiệu chuẩn do nhà sản xuất đưa ra phải không quá 2,5 %. Sử dụng các pipet có vạch định mức và đầu hút còn nguyên vẹn. Có thể sử dụng các pipet chuyển vi khuẩn hoặc các pipet phù hợp với tiêu chuẩn APHA được nêu trong Các phương pháp chuẩn để kiểm tra sản phẩm từ sữa với phiên bản mới nhất. Tốt nhất, bảo vệ đầu hút của tất cả các pipet bằng nút bông để loại trừ nguy hiểm đối với nhân viên hoặc để loại bỏ khả năng nhiễm bẩn mẫu qua nước bọt.
4.2.2. Sử dụng các ống đong chia độ có vạch định mức đáp ứng các tiêu chuẩn TCVN 2698:2007 (ASTM D-86), Sản phẩm dầu mỏ - Phương pháp xác định thành phần cất ở áp suất khí quyển và ASTM D 216, Method of Test for Distillation of Natural Gasonline (Phương pháp thử chưng cất sản phẩm dầu mỏ tự nhiên) và có giới hạn độ chính xác theo quy định hiện hành.
4.3. Hộp chứa môi trường nuôi cấy
Sử dụng bình định mức thủy tinh borosilicat sạch vô trùng để giảm sự nhiễm khuẩn. Có thể sử dụng bình định mức với mọi kích thước hoặc hình dạng, tuy nhiên bình định mức Erlenmeyer với nắp kim loại, phủ giấy tráng kim loại, hoặc các nút vặn để trộn môi trường tốt hơn và thuận tiện hơn cho bảo quản.
4.4. Đĩa nuôi cấy
4.4.1. Sử dụng đĩa Petri loại (60 x 15) mm, (50 x 12) mm, hoặc kích thước thích hợp khác. Đáy của đĩa phải phẳng và đủ rộng sao cho tấm hấp thụ môi trường nuôi cấy sẽ trải phẳng bề mặt của đĩa. Bọc các đĩa nuôi cấy riêng từng cái hoặc một số lượng thuận tiện bằng giấy kim loại trước khi khử trùng bằng nhiệt khô, hoặc bọc giấy phù hợp khi khử trùng bằng nồi hấp. Nếu sử dụng đĩa Petri thủy tinh, nên sử dụng borosilicat hoặc thủy tinh tương đương. Vì nắp các đĩa này là nắp lỏng, cần chú ý để tránh khả năng mất môi trường do bay hơi, dẫn đến sự thay đổi nồng độ môi trường, và để duy trì độ ẩm môi trường cho phát triển tối ưu của khuẩn lạc.
4.4.2. Có thể sử dụng các đĩa nhựa dùng một lần có nắp được lắp đặt và đáp ứng các yêu cầu kỹ thuật đã nêu ở trên. Các đĩa nhựa vô trùng có sẵn tấm dinh dưỡng là sản phẩm thương mại cũng rất thích hợp.
4.5. Thiết bị lọc
4.5.1. Thiết bị lọc gồm giá màng lọc (bằng thủy tinh, nhựa, sứ, hoặc bất kỳ kim loại trơ với vi khuẩn) và một phễu lọc được lắp chặt bằng móc cài hoặc được giữ chặt bằng lực từ trường hoặc trọng lực. Thiết kế phải sao cho màng lọc sẽ được giữ an toàn trên giá đỡ, không bị gây hư hại cơ học và tất cả chất lỏng sẽ qua màng trong quá trình lọc.
4.5.2. Bọc riêng hai phần của thiết bị bằng giấy bọc phủ để khử khuẩn bằng nồi hấp và bảo quản cho đến khi sử dụng. Cách khác, xử lý không cần giấy bọc bằng tia cực tím trước khi dùng. Có thể vệ sinh các dụng cụ ngoài hiện trường bằng cách đốt trong cồn metyl hoặc nhúng trong nước sôi 5 min. Không làm cháy các bộ phận bằng nhựa.
4.5.3. Để tiến hành lọc, gắn đế của bộ đỡ màng lọc dung tích 1 L với ống bên cạnh hoặc thiết bị phù hợp khác sao cho chênh lệch áp suất có thể tác động lên màng lọc. Nối bình với bơm không cần chân không, bơm lọc vận hành nhờ áp suất nước, một bộ hút bằng tay hoặc các phương tiện khác gây chênh lệch áp suất an toàn. Nối thêm một bình vào giữa bình lọc và nguồn chân không để chặn dòng nước tràn sang.
4.6. Màng lọc
4.6.1. Sử dụng màng lọc có đường kính lỗ danh định giữ được toàn hoàn vi khuẩn coliform trên màng (0,45 ± 0,02) mm. Chỉ sử dụng màng lọc đảm bảo chất lượng và được chứng nhận bởi nhà sản xuất là giữ được đầy đủ các loài được nuôi cấy, bền trong khi sử dụng, không có hóa chất độc hại với sự phát triển của vi khuẩn, tốc độ lọc thích hợp, không ảnh hưởng đáng kể đến pH, và không làm tăng về số lượng khuẩn lạc. Tốt nhất sử dụng màng lọc có đánh dấu lưới ô vuông sao cho vi khuẩn không bị ức chế hoặc kích thích phát triển dọc theo đường lưới. Lưu giữ màng lọc trong môi trường bình thường không có nhiệt độ và độ ẩm không quá khắc nghiệt. Thời gian lưu giữ không quá một năm kể từ ngày sản xuất hoặc theo quy định của nhà sản xuất.
4.6.2. Nếu sử dụng màng lọc đã được khử khuẩn, phải sử dụng màng lọc đã được nhà sản xuất chứng nhận về kỹ thuật khử khuẩn không tạo ra độc tố hoặc làm thay đổi đặc tính hóa học hoặc lý học của màng. Nếu màng lọc được khử khuẩn trong phòng thí nghiệm, tách bỏ giấy, nhưng không được tách tấm hấp thụ, ra khỏi màng lọc đã bao gói. Chia các màng lọc thành tập 10 chiếc đến 12 chiếc, hoặc theo số lượng khác cho thuận tiện, và đặt trong đĩa Petri 10 cm hoặc bọc trong giấy gói dày. Khử khuẩn trong nồi hấp 10 min ở 121 oC. Vào cuối giai đoạn khử khuẩn, cần phải để hơi nước thoát ra nhanh để giảm thiểu nước ngưng tụ trên màng lọc.
4.7. Tấm hấp thụ
4.7.1. Các tấm hấp thụ là các đĩa bằng giấy lọc hoặc có vật liệu khác có chất lượng cao, không có sunfit và các chất có thể gây ra ức chế sự phát triển của vi khuẩn. Sử dụng các tấm hấp thụ đường kính khoảng 48 mm và có bề dầy đủ để hấp thụ từ1,8 mL đến 2,2 mL môi trường nuôi cấy. Tấm hấp thụ đã được khử khuẩn hoặc tấm hấp thụ sẽ được khử khuẩn trong phòng thí nghiệm phải cho độ axit tổng số nhỏ hơn 1 mg (tính theo CaCO3) khi chuẩn độ bằng NaOH 0,02 N với chất chỉ thị phenolphtalein, pH = 8,3. Nếu có dấu hiệu về độ độc của tấm hấp thụ, tẩy rửa bằng nước cất loại II ở 121 oC (trong nồi hấp) trong 15 min, gạn nước, đóng gói các tấm hấp thụ lại và đặt lên một đĩa Petri lớn đem khử trùng để sử dụng dần. Có thể khử trùng các tấm hấp thụ đồng thời với màng lọc trong cùng bao giấy hoặc gói tách riêng trong các vật chứa thích hợp khác. Sấy khô các tấm hấp thụ sao cho không còn thấy hơi ẩm trước khi sử dụng. Xem qui trình khử khuẩn màng lọc như đã mô tả ở trên.
4.7.2. Có thể thêm 1,5 % thạch vào môi trường nuôi cấy coliform tổng số M-Endo để thay thế các tấm hấp thụ bão hòa chất dinh dưỡng.
4.8. Kẹp
Kẹp phải có mũi tròn, không có gờ ở mặt trong. Khử khuẩn kẹp bằng cách nhúng vào cồn etyl 95 % hoặc cồn methyl tuyệt đối và đốt thành ngọn lửa trước khi sử dụng.
4.9. Tủ ấm (nuôi cấy)
Sử dụng tủ nuôi cấy cung cấp được nhiệt độ (35 ± 5) oC và duy trì được mức độ ẩm cao (khoảng 90 % độ ẩm tương đối)
4.10. Kính hiển vi và nguồn sáng
Đếm các khuẩn lạc trên màng lọc dưới kính có độ phóng đại 10 lần đến 15 lần và điều chỉnh nguồn sáng sao cho tạo được ánh rõ nhất. Tốt nhất là sử dụng kính hiển vi trường rộng hai mắt kính. Tuy nhiên, có thể sử dụng kính lúp với đèn huỳnh quang nhỏ. Sử dụng ánh sáng huỳnh quang trắng-lạnh. Không sử dụng loại đèn chiếu sáng cho kính hiển vi có hệ thống quang học lập ánh sáng từ một nguồn nóng sáng để nhận dạng khuẩn lạc coliform trong môi trường Endo.
5. Thuốc thử
5.1. ASTM nước loại II (Nước cất 2 lần đạt chuẩn chất lượng TCVN 2117 (ASTM D1193) Nước thuốc thử - Yêu cầu kỹ thuật): Nước phải được giám sát về độ tinh khiết.
5.2. Môi trường M-Endo
5.2.1. Thành phần của môi trường:
Trytose hoặc polypepton | 10,0 g |
Thiopepton hoặc Thioton | 5,0 g |
Casiton hoặc Tryticase | 5,0 g |
Dịch chiết men | 1,5 g |
Lactoza | 12,5 g |
Natri clorua, NaCl | 5,0 g |
Dikali hydrophosphat, K2HPO4 | 4,375 g |
Kali dihydro phosphat, KH2PO4 | 1,375 g |
Natri laury sulphat | 0,050 g |
Natri desoxycholat | 0,10 g |
Natri sulphit, Na2SO3 | 2,10 g |
Fuchsin kiềm (thuốc nhuộm kiềm) | 1,05 g |
Nước cất (Loại II) | 1 lít |
5.2.2. Hòa 20 mL etanol 95 % vào 1 L nước cất loại II. Đun sôi trong bể điều nhiệt để tránh sự phân hủy của cacbonhydrat, chuyển ngay lập tức ra khỏi bể điều nhiệt và làm nguội xuống dưới 45oC. Không khử trùng bằng nồi hấp, pH cuối cùng phải nằm trong khoảng từ 7,1 đến 7,3.
5.2.3. Bảo quản môi trường hoàn tất trong tối ở 20C đến 100C và đổ bỏ môi trường chưa dùng sau 96 h. Môi trường mẫn cảm với ánh sáng.
CHÚ THÍCH: Môi trường này có thể làm đông kết bằng cách thêm 1,2 % đến 1,5 % thạch trước khi đun sôi.
5.3. Môi trường trytose lauryl: xem Method 9131 Total coliform - Muiltiple tube fermentation technique (Xác định Coliform tổng số - Kỹ thuật lên men nhiều ống), 5.3.
6. Lấy, bảo quản và xử lý mẫu
6.1. Tất cả các mẫu phải được lấy theo kế hoạch lấy mẫu được quy định trong các tiêu chuẩn về lấy mẫu vi sinh.
6.2. Làm sạch hoàn toàn tất cả các dụng cụ thủy tinh bằng chất tẩy rửa thích hợp và nước nóng, súc rửa bằng nước nóng để loại bỏ tất cả chất tẩy rửa còn dư lại, và cuối cùng, súc rửa bằng nước cất (loại II). Nếu sử dụng máy rửa, thì máy phải có hệ thống ống dẫn nước làm bằng thép không gỉ hoặc vật liệu không độc hại với vi khuẩn. Không sử dụng ống bằng đồng để dẫn nước cất loại II. Sử dụng hệ thống xả nước bằng thép không gỉ hoặc vật liệu không độc hại.
6.2.1. Khử khuẩn dụng cụ thủy tinh, ngoại trừ khi chứa trong hộp bằng kim loại, trong khoảng 60 min ở nhiệt độ 170 oC, nếu nhiệt độ toàn bộ là đồng nhất thì khử khuẩn ở 160 oC. Sấy dụng cụ thủy tinh trong hộp kim loại ở 170 oC trong thời gian không ít hơn 2 h.
6.2.2. Khử trùng chai chứa mẫu trừ các chai làm bằng nhựa, như trên, hoặc trong nồi hấp ở 121 oC trong 15 min.
6.2.3. Đối với những chai nhựa bị méo trong nồi hấp, khử trùng khí etylen oxit ở nhiệt độ thấp. Nếu chai được sử dụng để đựng mẫu có chứa clo dư và các halogen khác, thì cho vào lượng Na2S2O3 đủ để làm sạch tới nồng độ khoảng 100 mg/L mẫu trước khi đem khử trùng. Với chai 120 mL thêm 0,1 mL dung dịch Na2S2O3 10 % (sẽ trung hòa được mẫu chứa clorua dư 15 mg/L). Vặn nắp chai vừa đủ chặt, khử trùng bằng cách sấy khô hoặc ướt như đã nêu ở trên.
6.2.4. Nếu lấy mẫu nước có nồng độ đồng hoặc kẽm cao và mẫu nước thải có nồng độ các kim loại nặng cao vào chai có chứa sẵn chất tạo chelat thì sẽ làm giảm độ độc của kim loại. Việc này đặc biệt có ý nghĩa khi thời gian vận chuyển mẫu nhiều hơn 4 h. Sử dụng muối tetranatri của axit etylendiamintetraaxetic (EDTA) có nồng độ 372 mg/L. Điều chỉnh pH dung dịch EDTA về 6,5 trước khi dùng. Có thể thêm riêng biệt EDTA hoặc kết hợp EDTA với dung dịch Na2S2O3 vào chai trước khi khử khuẩn (0,3 mL dung dịch 10 % EDTA cho chai dung tích 120 mL).
6.3. Khi nạp mẫu vào chai, để một khoảng không khí trong chai (ít nhất là cao 2,5 cm) để thuận tiện cho việc lắc trộn mẫu trước phân tích. Chú ý khi lấy mẫu phải đại diện cho nước được thử nghiệm và tránh làm nhiễm bẩn mẫu tại thời điểm lấy mẫu hoặc trong thời gian trước phân tích (thử nghiệm).
6.4. Chai đựng mẫu phải được nút kín cho đến khi nạp mẫu. Mở nút chai cẩn thận để tránh đất và chất bẩn bắn vào chai. Trong khi lấy mẫu, không cầm nắp hoặc cổ chai, và bảo quản chúng sao cho không bị nhiễm bẩn. Giữ chai ở gần phần đáy chai, nạp mẫu vào chai đủ lượng cần thiết mà không được làm tràn ra, nắp nút chai ngay lập tức và đảm bảo phải chặt và chắc.
6.5. Cần tiến hành phân tích vi khuẩn của mẫu nước ngay sau khi lấy để tránh những thay đổi không dự đoán được. Nếu không thể phân tích mẫu trong vòng 1 h kể từ khi lấy mẫu, phải bảo quản lạnh khi vận chuyển đến phòng thí nghiệm.
6.6. Duy trì nhiệt độ của tất cả các mẫu ô nhiễm dưới 10 oC trong thời gian vận chuyển tối đa là 6 h. Giữ lạnh những mẫu này ngay khi đưa đến vào phòng thí nghiệm và phân tích trong vòng 2 h. Nếu thời gian vận chuyển cần nhiều hơn 6 h, nên phân tích ngay tại hiện trường bằng các thiết bị phân tích vi sinh (coliform) hiện trường hoặc sử dụng quá trình nuôi cấy kéo dài thời gian (tủ ấm ủ chậm)
7. Qui trình (xem Hình 1)
7.1. Lựa chọn lượng mẫu
7.1.1. Lượng mẫu lấy phân tích phụ thuộc vào mật độ vi khuẩn dự kiến và mật độ vi khuẩn này trong mẫu chỉ bị ảnh hưởng bởi độ đục.
7.1.2. Lượng mẫu lý tưởng là lượng mẫu cho khoảng 50 khuẩn lạc coliform và không quá 200 khuẩn lạc của tất cả các vi khuẩn. Với các mẫu nước đã qua xử lý, tiến hành lọc hai lượng mẫu thử như nhau, ví dụ như 100 mL hoặc 500 mL hoặc lớn hơn, hoặc hai thể tích mẫu đã pha loãng. Với các loại mẫu nước khác tiến hành lọc ba (lọc 3 mẫu) lượng mẫu thử khác nhau tùy thuộc vào mật độ vi khuẩn dự kiến. Nếu thể tích cần lọc nhỏ hơn 20 mL (pha loãng hoặc không pha loãng), thêm một lượng nhỏ nước cất vô khuẩn vào phễu lọc trước khi lọc. Việc tăng thể tích nước này giúp cho huyền phù vi khuẩn phân tán đồng đều trên toàn bộ bề mặt màng lọc.
7.2. Lọc mẫu
7.2.1. Dùng kẹp vô khuẩn, đặt màng lọc vô khuẩn trên giá đỡ màng lọc của bộ phận lọc, mặt có đường lưới hướng lên trên. Cẩn thận đặt phễu vào giá đỡ và cố định bằng khóa cài. Lọc mẫu trong điều kiện chân không yếu. Khi mẫu trong phễu vừa cạn hết, vẫn để nguyên màng lọc tại chỗ, tráng phễu ba lần bằng 20 mL đến 30 mL nước pha loãng vô khuẩn, Mở khóa và tháo phễu, dùng kẹp vô khuẩn chuyển màng lọc đặt lên tấm hấp thụ hoặc mặt thạch (tấm dinh dưỡng) theo cách trải thảm để tránh tạo bọt khí.
7.2.2. Sử dụng thiết bị lọc vô khuẩn mỗi khi bắt đầu một dãy lọc để giảm thiểu sự nhiễm bẩn ngẫu nhiên. Dãy lọc được coi là bị ngắt quãng khi thời gian dừng giữa các lần lọc mẫu lớn hơn 30 min. Sau những lần bị ngắt quãng như thế, cần xử lý mẫu như một dãy lọc mới và phải khử khuẩn tất cả các dụng cụ sử dụng.
7.2.3. Khử khuẩn dụng cụ giữa các dãy lọc bằng hơi nước, nước sôi, hoặc, nếu có thể, dùng máy khử khuẩn bằng tia cực tím. Khi sử dụng qui trình khử khuẩn bằng tia UV, thời gian 2 min phơi nhiễm với bức xạ UV là đủ để khử được 99,9 % vi khuẩn. Nên bảo vệ mắt để phòng tránh sự lọt bức xạ từ buồng khử khuẩn. Thiết bị UV này chưa phải là sản phẩm thương mại vì thế không yêu cầu bắt buộc phải sử dụng, nhưng không được khuyến nghị sử dụng.
7.3. Kỹ thuật làm giàu hai bước
7.3.1. Đặt tấm hấp thụ vô khuẩn lên nắp trên của đĩa nuôi cấy vô khuẩn và dùng pipet chuyển vào vừa đủ lượng môi trường làm giàu (từ 1,8 mL đến 2,0 mL môi trường lauryl trytose đến bão hòa). Cẩn thận loại bỏ lượng dung dịch thừa. Khử khuẩn nơi đặt màng lọc mà qua đó mẫu đã được chuyển vào tấm hấp thụ. Ủ màng lọc, mà không đảo đĩa trong thời gian 1,5 đến 2h ở (35 ± 0,5) oC, độ ẩm tương đối tối thiểu là 90 %.
7.3.2. Chuyển đĩa nuôi cấy làm giàu ra khỏi tủ ấm, nhấc màng lọc khỏi tấm hấp thụ và đặt nó lên trên bề mặt thạch. Nếu thấy có bọt khí dưới màng lọc, cẩn thận đặt lại màng lọc lên bề mặt thạch. Trong trường hợp sử dụng môi trường lỏng, chuẩn bị quá trình nuôi cấy tiếp theo bằng cách lấy đĩa nuôi cấy làm giàu ra khỏi tủ ấm và tách đĩa làm hai nửa. Đặt tấm hấp thụ vô khuẩn vào nửa đáy hộp lồng và bão hòa tấm hấp thụ từ 1,8 mL đến 2,0 mL môi trường M-Endo. Chuyển màng lọc có mẫu cẩn thận lên trên tấm hấp thụ mới. Loại bỏ miếng đệm đã dùng. Đảo đĩa chứa thạch hoặc môi trường lỏng và ủ trong khoảng 20 h đến 22 h ở (35 ± 0,5) oC.
CHÚ THÍCH: Hiện nay, trên thị trường có sẵn sản phẩm tấm dinh dưỡng (tấm hấp thụ đã có chất dinh dưỡng đựng trong hợp lồng vô khuẩn, khi sử dụng chỉ cần thêm nước cất theo lượng do nhà sản xuất quy định. Sử dụng các tấm dinh dưỡng có sẵn theo hướng dẫn của nhà sản xuất, nếu phù hợp.
7.4. Đếm
7.4.1. Khuẩn lạc coliform đặc trưng có màu hồng đến đỏ thẫm với bề mặt ánh kim. Vùng ánh kim có kích thước thay đổi từ chấm nhỏ đến phủ toàn bộ bề mặt khuẩn lạc. Quan sát và đếm các khuẩn lạc bằng kính hiển vi soi nổi trường rộng hai mắt độ phóng đại thấp (10 lần đến 15 lần) hoặc các thiết bị quang học tương tự với một nguồn ánh sáng huỳnh quang trắng như đã nêu ở trên và chiếu càng vuông góc với mặt phẳng màng lọc càng tốt. Tổng số khuẩn lạc đếm được (coliform và không phải coliform) trên môi trường M-Endo không có mối liên quan với tổng số vi khuẩn có trong mẫu gốc, và như đã biết không thể suy luận về mối tương quan với chất lượng của mẫu nước.
7.5. Tính toán mật độ coliform
7.5.1. Báo cáo mật độ coliform tính theo số coliform (tổng số)/100 mL. Tính số vi khuẩn coliform trên màng lọc có 20 khuẩn lạc coliform đến 80 khuẩn lạc coliform và không quá 200 khuẩn lạc của tất cả các vi khuẩn theo công thức sau:
(Tổng số) =
Vi khuẩn coliform/100 mL
7.5.2. Nước có chất lượng nước uống
7.5.2.1. Đối với nước có chất lượng tốt, số lượng khuẩn lạc coliform sẽ nhỏ hơn 20 trên một màng lọc. Trong trường hợp này, đếm tất cả các khuẩn lạc coliform và sử dụng công thức nêu ở trên để tính mật độ coliform.
7.5.2.2. Nếu xảy ra hiện tượng phát triển chập nhau, khi đó các khuẩn lạc phát triển chồng lên nhau trên một phần hoặc toàn bộ màng lọc thì báo cáo kết quả là "phát triển chập nhau". Nếu tổng số lượng khuẩn lạc coliform và không phải coliform và không phải coliform lớn hơn 200 trên mỗi màng lọc, hoặc nếu số khuẩn lạc quá nhiều không thể đếm chính xác, thì báo cáo kết quả là "quá nhiều không đếm được". Trong cả hai trường hợp này đều phải yêu cầu lấy một mẫu mới và chọn thể tích thích hợp hơn để lọc, cần lưu ý rằng thể tích mẫu thử tiêu chuẩn cho nước uống là 100 mL. Vì thế, thay cho 100 mL lọc trên một màng lọc bằng cách lọc với hai màng lọc, mỗi màng lọc 50 mL, hoặc lọc với bốn màng lọc, mỗi màng lọc là 25 mL, v.v … Đếm coliform tổng số quan sát được trên các màng lọc và báo cáo theo số lượng trên 100 mL.
7.5.3. Nước có chất lượng khác chất lượng nước uống
7.5.3.1. Tương tự như với các mẫu nước có thể uống được, nếu không có màng lọc nào có số lượng coliform đếm được nằm trong khoảng lý tưởng, báo cáo số lượng coliform theo tổng số khuẩn lạc đếm được trên tất cả các màng lọc cho 100 mL mẫu. Ví dụ, nếu hai phần mẫu, mỗi phần 50 mL được lọc trên hai màng lọc và tương ứng có năm và ba khuẩn lạc coliform, báo cáo kết quả là tám khuẩn lạc coliform trên 100 mL nghĩa là:
![]()
7.5.3.2. Tương tự, nếu các phần mẫu 50 mL, 25 mL và 10 mL được đem lọc và tương ứng có số khuẩn lạc coliform là 15, 6 và 1, báo cáo kết quả số khuẩn lạc là 25/100 mL, nghĩa là:
![]()
7.5.3.3. Mặt khác, nếu các phần mẫu 10 mL, 1,0 mL và 0,1 mL được lọc và tương ứng có số khuẩn lạc coliform là 40,9 và 1, thì chỉ chọn phần mẫu 10 mL để tính mật độ coliform vì màng lọc này có số lượng khuẩn lạc coliform nằm trong khoảng lý tưởng. Kết quả là 400/100 mL, nghĩa là:
![]()
Trong ví dụ cuối cùng này, nếu màng lọc có 40 khuẩn lạc coliform và có tổng số khuẩn lạc vi khuẩn lớn hơn 200, thì cũng báo cáo kết quả số khuẩn lạc coliform là 400/100 mL.
7.5.3.4. Báo cáo có "phát triển chập nhau" hoặc màng lọc có quá nhiều khuẩn lạc không thể đếm được" như đã nêu trong 7.5.2. Yêu cầu mẫu mới và chọn thể tích thích hợp hơn để lọc.
7.5.4. Mức độ tin cậy theo thống kê của kết quả sử dụng kỹ thuật màng lọc
Mặc dù mức độ tin cậy của kỹ thuật màng lọc theo thống kê là lớn hơn mức độ tin cậy của kỹ thuật MPN, nhưng số đếm trên màng lọc không phải là con số đúng tuyệt đối. Bảng 1 minh họa một số mức tin cậy 95 %.
Bảng 1 - Mức tin cậy 95 % đối với kết quả màng lọc sử dụng lượng mẫu 100 mL
Số lượng khuẩn lạc coliform đếm được | Mức tin cậy 95 % | |
Dưới | Trên | |
1 2 3 4 5 | 0,05 0,35 0,81 1,4 2,0 | 3,0 4,7 6,3 7,7 9,2 |
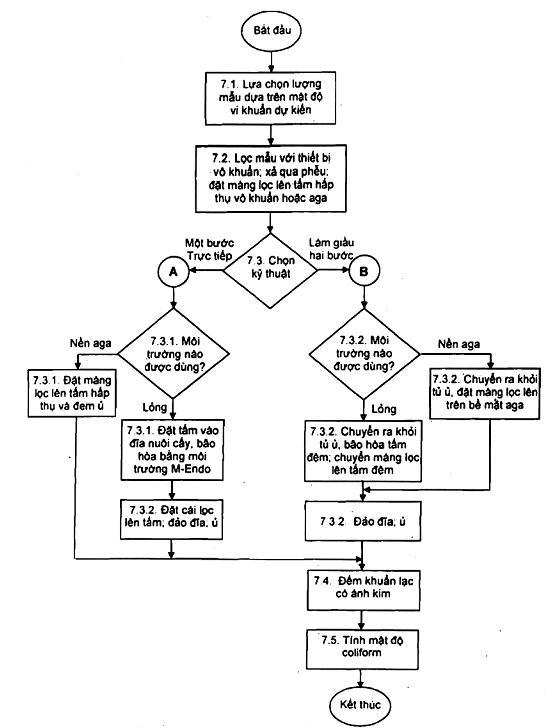
Hình 1 - Quy trình xác định coliform tổng số theo kỹ thuật màng lọc
8. Kiểm soát chất lượng
8.1. Qui trình kiểm soát chất lượng chung đã được nêu trong Phần IV của U.S. EPA. 1978[2]. Những qui trình này phải được thực hiện tại mọi thời điểm.
8.2. Mẫu phải được duy trì càng giống điều kiện ban đầu càng tốt bằng cách bảo quản và xử lý cẩn thận. Vị trí và tần suất lấy mẫu phải đại diện cho các đặc tính và tính thay đổi của chất lượng nước tại vị trí đó. Các mẫu phải được phân tích ngay lập tức. Nếu không thể phân tích ngay, thì mẫu phải được bảo quản lạnh ở nhiệt độ từ 1 oC đến 4 oC và phân tích trong vòng 6 h kể từ khi lấy mẫu.
8.3. Kiểm soát chất lượng của môi trường nuôi cấy có tính quyết định tới độ đúng của kết quả phân tích vi sinh. Một số yếu tố quan trọng cần chú ý được tổng hợp dưới đây.
8.3.1. Môi trường chỉ được dùng trong một năm: luôn luôn sử dụng dung dịch mua về trước. Duy trì bảng kê của tất cả các môi trường đã mua, kể cả kết quả kiểm tra bằng quan sát.
8.3.2. Lưu giữ môi trường nguyên gói không quá hai năm. Các gói môi trường đã mở phải loại bỏ sau sáu tháng.
8.3.3. Khi chuẩn bị môi trường, làm sao để thời gian mở các gói chứa môi trường càng ngắn càng tốt. Chuẩn bị môi trường bằng nước đã loại ion hoặc nước cất (loại II) có chất lượng được chứng nhận. Kiểm tra pH của môi trường sau khi pha thành dung dịch và khử khuẩn; pH phải trong khoảng 0,2 đơn vị so với giá trị quy định. Nếu không đạt, phải loại bỏ và làm lại.
8.3.4. Thời gian tối thiểu khi khử khuẩn bằng nồi hấp do nhà sản xuất qui định, vì nguy cơ làm hư hỏng môi trường sẽ tăng cao khi tiếp xúc nhiều với nhiệt. Lấy môi trường đã khử khuẩn ra khỏi nồi hấp ngay khi áp suất về không. Hiệu quả của việc khử khuẩn phải được kiểm tra hằng tuần, sử dụng strip hoặc ampuls Bacillus stearothemophelus.
8.3.5. Phải để các đĩa thạch hơi mở trong khoảng 15 min sau khi rót hoặc chuyển ra khỏi tủ lạnh để làm bay hơi ấm. Các đĩa thạch phải có bề mặt bằng phẳng, không bị vón cục hoặc có bọt khí vì chúng có thể làm giảm sự tiếp xúc giữa thạch với môi trường.
8.3.6. Kiểm tra chất lượng của môi trường đã chuẩn bị bao gồm cả việc ủ là 5 % của mỗi mẻ môi trường trong hai ngày tại 35 oC để giám sát sự phát triển của khuẩn lạc và kiểm tra âm tính/dương tính với môi trường nuôi cấy nguyên chất.
8.4. Qui trình kiểm soát chất lượng phân tích phải bao gồm
8.4.1. Phân tích lặp ít nhất 10 % của tất cả mẫu dương tính đã biết.
8.4.2. Phân tích ít nhất một mẫu kiểm tra dương tính cho từng tháng với từng thông số thử nghiệm.
8.4.3. Phân tích ít nhất một mẫu kiểm tra âm tính cho từng loạt mẫu phân tích sử dụng nước đệm và mẻ môi trường đem sử dụng tại thời điểm bắt đầu của loạt phép thử và cứ sau mỗi mười mẫu. Khi mẫu kiểm tra cho thấy có nhiễm bẩn, thì phải tẩy và phân tích mẫu mới.
8.4.4. Sử dụng nước cất loại II để kiểm tra định kỳ về sự nhiễm bẩn.
8.5. Các qui định kiểm soát chất lượng đối với màng lọc
8.5.1. Có thể mua các bộ lọc màng vô khuẩn hoặc được đóng gói để khử khuẩn. Màng lọc này có thể được khử khuẩn bằng nồi hấp, dùng etylen oxit, hoặc chiếu xạ. Nhà sản xuất màng lọc phải chứng nhận các màng lọc của họ đáp ứng được các qui định về tính vô khuẩn, độ bám, độ thu hồi, cỡ lỗ, tốc độ dòng, pH, độ axit tổng, hàm lượng phosphat, và các quy định khác.
8.5.2. Tính năng của màng lọc phải được thử để đảm bảo các kết quả là phù hợp. Phải kiểm tra sự phù hợp của mỗi lô hàng về hình dạng, đường kẻ lưới, khả năng khuếch tán và sự phát triển đúng của khuẩn lạc. Cần phải xem xét những màng lọc không có khuẩn lạc phát triển trên vùng có diện tích lớn.
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Standard methods for Examination of Water and Wastewater, 15th ed.
[2] Bordner, R. H., et al., Microbiological Methods for Monitoring the Environment, Environmental Monitoring and Support Laboratory, U.S. EPA, Cincinnati, OH, EPA-600/8-78-017, 1978.

